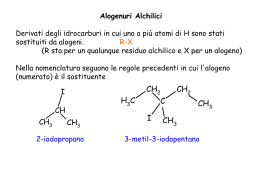
GLI ALCOOLI Gli alcooli sono composti di formula generale R-OH, dove R è un gruppo alchilico qualsiasi, anche sostituito, che può essere primario, secondario o terziario, a catena aperta o ciclico. Gli alcoli si possono considerare formalmente derivanti dall’acqua per sostituzione di un atomo di idrogeno con un gruppo alchilico. Sono caratterizzati dalla presenza del gruppo ossidrile: 1 Struttura Il gruppo ossidrile degli alcoli è legato ad un atomo di carbonio sp3. L’alcool più semplice è il metanolo. Metanolo. È estremamente tossico (15 ml causano la cecità, 100 ml causano la morte). È prodotto industrialmente dal gas a 400°C: È un comune solvente industriale. È usato come carburante. 2 Etanolo. È prodotto industrialmente per idratazione dell’etilene. Si ottiene anche per fermentazione di zuccheri e amidi ad opera di lieviti. 2-propanolo o isopropanolo. Ha deboli proprietà antibatteriche per cui viene usato per disinfettare strumenti medicali o per pulire la pelle prima di un piccolo intervento. Evapora rapidamente lasciando un senso di freschezza. • Sintesi industriale: Etilen glicole. E’ il componente principale degli anticongelanti. È tossico. 3 NOMENCLATURA Il nome IUPAC di un alcool si forma dal nome del corrispondente alcano, dopo aver individuato la catena più lunga di atomi di carbonio che contiene l’ossidrile, sostituendo il suffisso -o con il suffisso –olo La catena base deve essere numerata in modo da assegnare all’ossidrile il numero più basso possibile I nomi comuni, invece, si formano indicando il nome del raggruppamento alchilico legato all’ossidrile preceduto dalla parola alcool Un alcool è 1ario, 2ario o 3ario se l’atomo di carbonio che porta legato l’ossidrile lega a sua volta uno, due o tre atomi di carbonio. Classificazione: 4 Polioli Composti con 2, 3, 4 gruppi OH si chiamano dioli, trioli, tetraoli, etc. Gli 1,2 dioli (dioli vicinali) sono chiamati glicoli. I nomi comuni dei glicoli usano il nome dell’alchene dai quali derivano. 5 PROPRIETÀ FISICHE DEGLI ALCOLI Gli alcoli sono composti polari. La differenza di elettronegatività tra ossigeno (3.5) e carbonio (2.5) è 1.0 e tra ossigeno e idrogeno (2.1) è 1.5. Nello stato liquido formano legami H forti, che influenzano fortemente le proprietà fisiche: Infatti, i legami H tengono unite le molecole dell’alcool facendone aumentare il punto di ebollizione e, in modo analogo, permettono l’interazione attrattiva responsabile della miscibilità degli alcooli con l’acqua. 6 SOLUBILITA’ IN ACQUA Man mano che aumenta la catena di atomi di C, l’alcool diventa sempre meno solubile in H2O: R-OH C1 ↔ solubile C4 ↔ poco solubile Perché? ↔ Cn insolubile Fino a a 4 atomi di C l’effetto idrofilo prevale su quello lipofilo CH3 – O – H porzione lipofila C6 porzione idrofila Tra 4 e 6 atomi di C si ha la formazione di “Micelle”, ossia raggruppamenti di 5-6 molecole che si disperdono in H2O Oltre i 6 atomi di C prevale l’effetto lipofilo 7 ACIDITA’ E BASICITA’ DEGLI ALCOLI Sappiamo che l’H2O è una sostanza anfotera, ossia è contemporaneamente un acido ed una base, ma entrambi deboli: H–O–H OH- + H+ Sarebbe più corretto scrivere: 10-15 2 H2O H3O+ + OH- La costante di dissociazione dell’H2O è = 10-15, il che significa che su 1 milione di miliardi di molecole d’acqua, solo 1 molecola si trova nella forma dissociata. Non ha senso dunque parlare di acidità dell’acqua. La basicità dell’H2O è dovuta alla presenza dell’O che ha una coppia di elettroni, ma tende poco a metterla a disposizione per un legame (è uno scarso nucleofilo). 8 + CH3 – O – H + CH3 – O – H l’alcol metilico è meno acido dell’acqua CH3 – O- – H+ Il gruppo R – O- viene detto alcolato, nel caso specifico CH3 - O- sarà detto metilato 9 OSSIDAZIONE DEGLI ALCOLI Supponiamo di trattare un alcol con un forte agente ossidante, ad es., KMnO4, o K2Cr2O7: O CH3 – CH2 – CH2 CH3 – CH2 – C H Da un alcol primario si forma un’aldeide OH 1-propanolo Aldeide propionica CH3 – C – CH3 OH O 2-propanolo 2-propanone ═ CH3 – CH – CH3 Da un alcol secondario si forma un chetone Gli alcoli terziari non hanno reazioni di ossidazione. 10 Le aldeidi, in presenza degli stessi ossidanti, possono ulteriormente ossidarsi dando origine ad un “acido carbossilico”: CH3 – CH2 – CH2 V1 O CH3 – CH2 – C H V2 O CH3 – CH2 – C O–H OH Se V1 e V2 sono, rispettivamente, le velocità del 1° e del 2° processo, avremo: V2 > V1 : significa che la velocità di ossidazione dell’aldeide in ac. carbossilico è molto più grande di quella di ossidazione dell’alcol ad aldeide. Quindi, l’aldeide appena si forma viene ossidata, per cui al termine della reazione avremo solo ac. carbossilico V1 > V2 : significa che la velocità di formazione dell’aldeide è maggiore di quella della sua ossidazione ad ac. carbossilico, per cui a fine reazione avremo un accumulo di aldeide 11 12
Scaricare