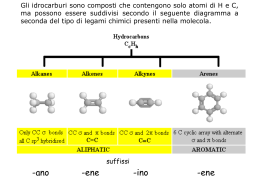
LA CHIMICA ORGANICA La Chimica Organica • I quattro elementi idrogeno, idrogeno carbonio, carbonio azoto e ossigeno rappresentano più del 95% dei costituenti della materia vivente. • I composti organici sono composti covalenti che hanno come struttura elementare principale delle catene di atomi di carbonio legati fra di loro con legami covalenti e legati ad atomi di idrogeno. • Possono fare parte delle diverse strutture anche altri elementi come l’ossigeno e l’azoto. • Poiché la differenza di elettronegatività tra questi elementi è molto piccola, le strutture che ne derivano sono essenzialmente covalenti e debolmente polarizzate. polarizzate La struttura delle molecole organiche • Le molecole organiche sono quindi formate essenzialmente da atomi di carbonio legati tra di loro e legati a loro volta ad atomi di idrogeno. • Per descrivere in maniera generale una molecola organica si usa la formula bruta che riporta il numero di atomi di carbonio, di idrogeno e di altri elementi contenuti nel composto. C6H14 esano C 6H 6 benzene C2H5OH etanolo Isomeri strutturali • Per descrivere nel modo esatto una molecola organica è però necessario descrivere in modo analitico anche come sono legati gli atomi tra di loro in quanto spesso la stessa formula bruta può corrispondere a composti diversi C6H14 esano o 2,3-dimetilbutano • In questo caso i diversi composti si definiscono isomeri strutturali Formule di struttura • Per differenziare tali isomeri è necessario descriverli con la loro formula di struttura. • Per scrivere le formule di struttura si scrive prima la struttura di atomi di carbonio e quindi si saturano le valenze del carbonio (l’atomo di carbonio forma sempre 4 legami nei composti neutri e saturi) con gli atomi di idrogeno o gli altri atomi tenendo conto della loro valenza. CC 6H 1414 6H H H H H H H H CC CC CC CC CC CC H H H H H H H esano esano H H H C H H H CC CC H CC CC H H H H CC H H H 2,3-dimetilbutano 2,3-dimetilbutano Formule di struttura • Per comodità gli atomi di idrogeno possono essere scritti a lato degli atomi di carbonio senza evidenziare i legami con essi H H H H H H H C C C C C C H H H H H H H esano H3C CH3 CH2 H2 C C H2 CH2 H2 C C6H14 H H H C H H H C C H C C H H H H C H H H CH3 C H2 CH2 2,3-dimetilbutano C H CH3 H3C H C CH3 CH3 CH2 CH3 CH3 CH3 CH3 CH CH CH3 Formule di struttura • Per abbreviare la formula si possono raggruppare i gruppi uguali CH3 CH2 CH2 CH2 CH2 CH3 CH3 CH3 CH3 CH CH CH3 esano 2,3-dimetilbutano CH3(CH2)4CH3 (CH3)2CHCH(CH3)2 Formule di struttura • Per abbreviare ancor più la notazione è consuetudine anche descrivere la struttura di una molecola organica attraverso la sola descrizione dei legami carbonio-carbonio e degli eventuali legami con altri atomi esano CH3 CH2 CH2 CH2 CH2 CH3 H2 C H2 C pentanolo H3C CH3 C C C C C C H H OH C C H3C CH3 C C C C C CH3 CH2 CH2 CH CH2 3 CH CH2 3 OH CH3 H3C C C H2 CH3H2CH CH CH3 H2 H2 CH3 C OH C 2,3-dimetilbutano C OH C C H3C C H CH3 C C C C C H2 H2 H H C C C C 3 C C C CH3 C Formule di struttura • In questa notazione è bene precisare che i legami con gli atomi di idrogeno non vengono scritti o se vengono scritti devono riportare l’atomo di idrogeno. esano CH3 CH2 CH2 CH2 CH2 CH3 esano H H H H H H C C C H C C C H H H H H H H CH3 CH2 CH2 CH2 CH2 CH3 C C C C C C H H H H H H H H H H H H H H NO ! Rappresentazioni della disposizione spaziale • Per rappresentare su carta la disposizione tridimensionale degli atomi nello spazio si possono usare tre notazioni differenti: – Formule prospettiche H H – Proiezioni a cavalletto – Proiezioni di Newman H H H H Proiezioni di Newman Formule di Proiezione di Fischer Ruoto intorno al legame C-CH3 la molecola in modo da spostare dietro l'H a destra il Cl e avanti il Br CH3 C Br Cl H CH3 Br C Cl H CH3 Br C Cl H Ottengo la proiezione di Fisher nella quale i legami orizzontali escono dal piano e quelli verticali entrano nel piano Classificazione • Nei composti organici gli atomi di carbonio sono classificati in base al numero di atomi di carbonio a cui sono legati: • Primario (1°): legato a un solo atomo di carbonio • Secondario (2°): legato a due atomi di carbonio • Terziario (3°): legato a 3 atomi di carbonio • Quaternario (4°): legato a 4 atomi di carbonio Classificazione per Struttura molecolare • Le sostanze organiche possono essere classificate in base alla loro struttura molecolare e cioè in base a come sono legati tra loro gli atomi, in: – Composti aciclici – Composti carbociclici O – Composti eterociclici O Composti aciclici • Con il termine aciclico si intende una struttura che non è ciclica e quindi nella struttura di tali composti non sono presenti anelli. • Le catene di atomi di carbonio possono essere lineari o ramificate • Possono contenere atomi diversi dal carbonio e dall’idrogeno 2,3-dimetilpentano ottano O OH geraniolo 2-butanone Composti carbociclici • Sono formati da anelli di atomi di carbonio. • Sono possibili anelli che vanno da 3 a molti atomi di carbonio. • Gli anelli a 5 o 6 atomi sono i più comuni. • Possono contenere legami multipli o essere formati da più anelli. O OH O testosterone muscone benzene limonene Composti eterociclici • Sono formati da anelli di atomi di carbonio contenenti almeno un atomo diverso dal carbonio (eteroatomo). • Gli eteroatomi più comuni sono N, O e S. • Possono contenere legami multipli o essere formati da più anelli. NH2 N N N N CH3 N H N nicotina O adenina S S α-tertienile cumarina S O Classificazione per Gruppo funzionale • I composti organici possono anche essere classificati in base alla presenza o meno nella struttura base di un gruppo di atomi legati fra loro secondo una particolare sequenza e struttura che viene detto gruppo funzionale. funzionale • La presenza della sola struttura base di atomi di carbonio e di idrogeno legati tra loro con legami semplici identifica la classe degli alcani. • Su tale struttura base possono essere poi costruite le varie classi di composti Gruppi funzionali Gruppi funzionali Le reazioni organiche • Le reazioni chimiche delle diverse classi di composti organici si possono classificare in diversi modi: • – Tipo di rottura del legame – Tipo di reagente – Tipo di prodotto Reazioni Eterolitiche • Gli elettroni che formano i legami che vengono rotti si spostano entrambi su uno dei due frammenti che si forma. • Spesso (ma non sempre) si ha il coinvolgimento di intermedi ionici. C O H + C O H Reazioni Omolitiche • Gli elettroni che formano i legami che vengono rotti si spostano ognuno su uno dei due frammenti che si forma. • Nella maggior parte dei casi si ha la formazione di specie radicaliche. C C . C . C Tipo di Reagente H BF3 CH3 elettrofili • OH Cl radicali Cl NH3 nucleofili Prodotto Finale H H C C H H H OH H C C H H H H Cl + H Cl H C C H H H addizione H H C C eliminazione H H + H OH Prodotto Finale H Cl H OH H C C H + H OH H H sostituzione H C C H + H Cl H H Prodotto Finale X A Riarrangiamento B A . A X - e+ A X Ossidazioni X + eRiduzioni B . A X - RIDUZIONI Aumento degli atomi di IDROGENO Diminuizione degli atomi di OSSIGENO H H C C O C C H H H C = -1-1+1 = - 1 C = -1-1-1 = - 3 H H C C C C C H H H C = -1-1+0 = - 2 C = -1-1-1 = - 3 H H C C O C C O C C H H H H C = -1-1+1 = - 1 C = -1-1-1 = - 3 C = -1+2 = +1 OSSIDAZIONI Aumento degli atomi di OSSIGENO Diminuizione degli atomi di IDROGENO H C C O C C O H H C = -1-1+1 = - 1 C = -1+2 = +1 C C O C C O H O C = -1+2 = +1 C = +2+1 = +3 H H C C H C C O H H C = -1-1-1 = - 3 C = -1-1+1 = - 1 Uso delle frecce Nel descrivere le reazioni organiche si usano spesso le frecce curve che descrivono il movimento degli elettroni all’interno della molecola. Quando si muovono due elettroni accoppiati il movimento viene descritto con una freccia curva a due alette. Quando si muove un elettrone singolo si usa una freccia curva ad una aletta Le frecce dritte descrivono le reazioni complete Le frecce doppie descrivono le reazioni di equilibrio Le frecce a due punte descrivono le strutture in risonanza
Scaricare