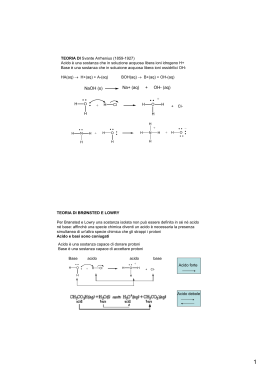
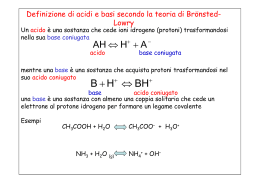
Cos’è il pH • Il pH è legato al concetto di acido e base • Il pH esprime il grado di acidità o basicità di una soluzione • Il pH esprime la misura della concentrazione di ioni idronio di una soluzione Il grado di acidità e di basicità si misura mediante una scala i cui valori a 25 °C sono compresi tra 1 e 14, chiamata scala di pH. pH = 7 indica la neutralità pH < 7 indica l’acidità pH > 7 indica la basicità Si definisce pH il logaritmo negativo (in base 10) della concentrazione di ioni idrogeno di una soluzione pH = - log 10 [ H+] = - log 1010 –x Per cui l’esponente della potenza che esprime la concentrazione degli ioni H+, cambiato di segno, diventa immediatamente il pH. Sostanze di uso quotidiano Pioggia Aceto pH 0 1 2 3 4 Succo d’arancio 5 6 Sangue 7 8 9 10 11 12 13 14 Latte Ammoniaca per uso • Teoria di Arrhenius: sono acide (basiche) tutte quelle sostanze che, poste in acqua, sono capaci di dissociarsi formando ioni H+ (OH-). • Teoria di Brönsted-Lowry: un acido (base) è una specie che ha tendenza a perdere (acquistare) un protone. • Teoria di Lewis: un acido (base) è una qualsiasi sostanza capace di accettare (donare) una coppia di elettroni di non-legame L'autoionizzazione dell'acqua H2O + H2O = Acido Base [H3O+][OH–] K = —————— [H2O]2 a 25 °C: H3O+ + OH– Acido Base K·[H2O]2 = Kw = [H3O+][OH–] prodotto ionico dell'acqua Kw = [H3O+][OH–] = 10–14 Il ph e il pOH - Definizione - Definizione pH log[ H 3O ] - Definizione pOH OH] ] pOHlog[ log[ OH Relazione tra pH e il pOH 2H2O H3O+ + OH- Kw Kw= [H3O+][OH-] Kw [H O ] 3 [OH ] Kw [OH ] [ H 3O ] -log Kw = pKw= -log[H3O+] – log[OH-] = pH + pOH pH + pOH = 14.0 DETERMINAZIONE SPERIMENTALE DEL pH Il grado di acidità o basicità di una soluzione si può misurare utilizzando gli indicatori acido-base od il piaccametro. Gli INDICATORI sono sostanze organiche aventi la proprietà di assumere diverso colore quando vengono a contatto con un acido o una base. • La figura seguente mostra l’utilizzo dell’indicatore universale, una cartina preparata con un miscuglio di indicatori, in grado di assumere tonalità di colore differenti a seconda della concentrazione di ioni H+ o OH-. • In base al colore si può risalire al valore del pH Mediante l'indicatore universale vediamo che le varie soluzioni si colorano di determinati colori; questi colori rappresentano il pH della sostanza (acida, basica o neutra) • Per misure più accurate del pH si può impiegare uno strumento apposito, detto PIACCAMETRO. Esso consente di misurare il pH immergendo una sonda costituita da un elettrodo a vetro direttamente nella soluzione e leggendo su un’apposita scala il valore del pH.
Scaricare