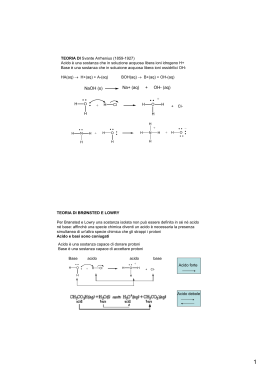
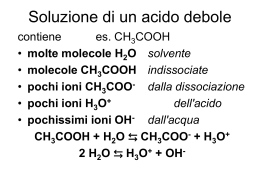
ACIDI, BASI e pH • Teoria di Arrhenius: sono acide (basiche) tutte quelle sostanze che, poste in acqua, sono capaci di dissociarsi formando ioni H+ (OH-). • Teoria di Brönsted-Lowry: un acido (base) è una specie che ha tendenza a perdere (acquistare) un protone. • Teoria di Lewis: un acido (base) è una qualsiasi sostanza capace di accettare (donare) una coppia di elettroni di non-legame Esempio. Nelle seguenti reazioni, qual è l’acido e quale la base? NaOH OH- + Na+ Base HCl + H2O Cl- + H3O+ Acido Base Base NH3 + H2O Base Acido Acido OH- + NH4+ Base Acido Coppia coniugata acido-base La forza degli acidi e delle basi forza acida di un qualsiasi acido HA è data dal valore numerico più o meno elevato della costante di equilibrio della reazione: [H3O+][A–] K = —————— [HA][H2O] HA + H2O = H3O+ + A– [H3O+][A–] K·[H2O] = Ka =————— [HA] Ka costante di dissociazione, o costante di ionizzazione, dell'acido più elevato è il valore di Ka, più l'acido è forte, più tende a dissociarsi più piccolo è il valore di Ka, più l'acido è debole, meno tende a dissociarsi esiste una relazione tra la forza di un acido e quella della sua base coniugata più un acido è forte, più la sua base coniugata è debole e viceversa B + H2O = HB+ + OH– [HB+][OH–] K·[H2O] = Kb = —————— [B] La costante di equilibrio Kb viene definita costante didissociazione, o costante di ionizzazione, della base Più elevato è il valore di Kb, più la base è forte L'autoionizzazione dell'acqua H2O + H2O = H3O+ + OH– Acido Base [H3O+][OH–] K = —————— [H2O]2 a 25 C: Acido Base K·[H2O]2 = Kw = [H3O+][OH–] prodotto ionico dell'acqua Kw = [H3O+][OH–] = 10–14 pH l'inverso del logaritmo della concentrazione molare degli ioni idrogeno presenti in tale soluzione pH = –log [H3O+] pH = –log [H+] • se pH < 7 acida • se pH = 7 neutra • se pH > 7 alcalina (o basica) il pH può essere rispettivamente minore di 0 o maggiore di 14 • se [H3O+] > 1 M, il pH < 0 • se [OH–] > 1 M, il pH > 14 Appendice: i logaritmi Si dice logaritmo in base a di un numero x l'esponente y da dare ad a per ottenere x. Ovvero se: x = ay allora y = logax loga1 = 0 loga(xz) = logax + logaz loga(x/z) = logax – logaz logaxk = k logax Esempio. Calcolare il pK, pH e pOH di una soluzione neutra di acqua a 25 C. Kw = [H3O+][OH–] = 10–14 pKw = -log Kw = -log (10-14) = 14 Poiché la soluzione è neutra: [OH–] = [H3O+] Kw = [H3O+][OH–] = [OH–]2 = [H3O+]2 = 10–14 [OH–] = [H3O+] = 10–14 = 10–7 M pOH = pH = 7 pKw = -log Kw = -log ([H3O+][OH-]) = = -log[H3O+] - log[OH-] = = pH + pOH Il pH di soluzioni di acidi forti, o di basi forti pH, di una soluzione di HA con CHA = 0,1 M H3O+ + A– HA + H2O iniziale finale 0.1 - - - - - 0.1 0.1 [H3O+] = CHA pH = –log [H3O+]= –log CHA = -log 0.1 = 1 per soluzioni di acidi forti monoprotici la concentrazione degli ioni idrogeno è pari alla concentrazione molare dell’acido stesso pOH, di una soluzione di B di CB = 0,1 M B + H2O OH- + HB+ [OH-] = CB pOH = –log [OH-]= –log CB = -log 0.1 = 1 pH = 14 – pOH = 14 – 1 = 13 per soluzioni di basi forti monoidrossiliche la concentrazione degli ioni idrossile è pari alla concentrazione molare della base stessa Calcolare il pH e la concentrazione delle specie ioniche in una soluzione 8,62·10-1 M dell’acido forte HClO4. HClO4 + H2O H3O+ + ClO4 – 8,62·10-1 mol HClO4= mol H3O+ = mol ClO4 – [H3O+] = [ClO4 – ] = 8,62·10-1M pH = –log [H3O+]= –log (8,62·10-1M) = 0,0645 Il pH di soluzioni di acidi deboli o di basi deboli pH, di una soluzione di HA, acido debole Co = concentrazione molare iniziale HA + H2O H3O+ + A– [A–][H3O+] Ka = ————— [HA] A equilibrio raggiunto, quali sono le concentrazioni, delle specie H3O+, A–, HA ? le possibili fonti di ioni H3O+ sono due: • la dissociazione dell'acido • l'autoionizzazione dell'acqua l’autoionizzazione dell’acqua trascurabile, quindi tutti gli ioni H3O+ presenti in soluzione provengono dalla dissociazione dell'acido Incognita [H3O+] = [A–] [A–][H3O+] Ka = ————— [HA] [H3O+]2 ———— [HA] Incognita 1.Considerazione. Ka è “piccola” = la reazione di dissociazione dell'acido decorre in misura esigua 2. Approssimazione. delle moli iniziali solo una “piccola” parte subisce ionizzazione, quindi si può approssimare: [HA] Ka [H3O+]2 —————— [HA] Co [H3O+]2 ———— C0 il pH di soluzioni di acidi deboli [H3O+] Ka·Co pH = 1/2 pKa - 1/2 logC0 Purchè: Ka sia piccola (acido piuttosto debole) e Co grande (soluzione sufficientemente concentrata), tale che Ka << C pOH, di una soluzione di B: B + H2O o OH- + BH+ [BH+][OH–] Kb = ————— [B] trascurando gli ioni OH– provenienti dall'autoionizzazione dell'acqua, [BH+] = [OH–] dato l'esiguo valore di Kb, si può approssimare che: [B]equilibrio = Co – [B]dissociata = Co – [BH+]formatosi = Co – [OH–] [BH+][OH–] Kb = ————— [B] [OH–]2 ——— [B] [OH–]2 ——— Co pOH, e quindi pH (pH = 14 - pOH), di soluzioni di basi deboli [OH–] Kb·Co Co Esempio. Calcolare il pH in una soluzione 1,00 M di acido acetico sapendo che la sua costante di dissociazione è Ka= 1,85·10–5. CH3COOH + H2O = CH3COO– + H3O+ [CH3COO–][H3O+] Ka = ———————— = 1,85·10–5 [CH3COOH] [CH3COOH] [H3O+] = [CH3COO–] Ka [H3O+] Ka·Co [H3O+]2 —————— [CH3COOH] [H3O+] Co [H3O+]2 ———— C0 1,85·10–5·1,00 = 0,00430 M pH = –log [H3O+]= –log (4,30·10-3 M) = 2,366 L’ammoniaca è una base debole con Kb= 1,79·10–5. Calcolare quale concentrazione deve avere una soluzione di ammoniaca perché il suo pH sia 11,040. NH3 + H2O = NH4+ + OH[NH4+][OH-] Kb = —————— = 1,79·10–5 [NH3] [H3O+] = 10–11,040 = 9,12·10–12 M [OH–] = Kw / [H3O+] = 1,00 10–14/ 9,12·10-12 = 1,10·10-3 M [OH–] Kb·Co C0 C0 [OH–] 2 —————— Kb (1,10·10-3 M) 2 —————— = 6,76 ·10-2 M 1,79·10–5
Scaricare