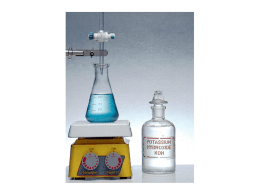
Titolazioni acido- base 1. Titolazione di un acido forte con una base forte : HCl(aq) + NaOH(aq) (a cura di Giuliano Moretti) Escludendo le specie spettatrici la reazione che descrive la titolazione è la seguente H3O+(aq) + OH-(aq) → 2 H2O(l) Titoliamo 15,0 mL di una soluzione di HCl(aq) allo scopo di determinarne la concentrazione (il titolo). Utilizziamo come base titolante una soluzione di NaOH(aq) 0,100 M. Per disegnare la curva di titolazione pH in funzione del volume V di base aggiunto assumiamo HCl(aq) 0,100 M. Apparato sperimentale Per la determinazione del punto equivalente aggiungiamo alla soluzione di 15,0 mL di HCl(aq) da titolare due gocce di soluzione di indicatore metil-arancio. Con una buretta graduata aggiungiamo goccia a goccia la soluzione di NaOH(aq)0,100 M al beaker contenente la soluzione di HCl(aq). Il beaker è sistemato sopra un agitatore magnetico. La soluzione è agitata per mezzo di un’ancoretta magnetica. Si tenga presente che 2 gocce equivalgono a circa 0,10 mL, quindi la precisione con cui misuriamo il volume aggiunto con la buretta è di una goccia, cioè circa 0,05 mL. Curva di titolazione Per disegnare la curva di titolazione, cioè il grafico che riporta il pH della soluzione in funzione del volume V di base forte aggiunto, consideriamo i calcoli seguenti. Assumendo che la concentrazione iniziale di HCl(aq) sia Ca0 = 0,100 M, nel beaker abbiamo 15,0 • 0,100 = 1,50 mmol di acido. (Ricordiamo che dimensionalmente per la molarità vale la relazione M ≡ mol L-1 ≡ mmol mL-1.) A) Calcolo del pH iniziale Essendo l'acido forte completamente dissociato possiamo scrivere [H3O+] = 0,100 M da cui pH = - log [H3O+] = 1. B) Calcolo del pH prima del punto equivalente Per ogni volume di base aggiunto possiamo scrivere l'equazione [H3O+]=(mmol H3O+/ mL soluzione) = [(1,50 – V • 0,100)/ (15,0 + V)] pH = - log [H3O+]. C) Calcolo del pH al punto equivalente Secondo la reazione HCl(aq) + NaOH(aq)→ H2O(l)+ NaCl(aq) (H3O+ + OH- → 2H2O(l)) Il punto equivalente è quello in cui abbiamo aggiunto un numero di moli di NaOH(aq) esattamente uguale alle moli di HCl(aq) : mmol H3O+= mmol OH-. In pratica al punto equivalente abbiamo una soluzione acquosa di cloruro di sodio. Notiamo che sia Na+(aq) sia Cl(aq) non reagiscono con H2O(l) in quanto provengono rispettivamente da una base forte e da un acido forte; nella soluzione esiste solo il seguente equilibrio : 2H2O(l) H3O+ + OH- ; [H3O+][OH-] = Kw = 1,00 • 10-14 [H3O+] = [OH-] ; [H3O+] =√ Kw =1,00 • 10-7 , da cui pH = 7. (La reazione H3O+ + OH- → 2H2O(l) è praticamente completa in quanto la sua costante d’equilibrio vale K = 1 / Kw =1,00 • 1014.) D) Calcolo del pH dopo il punto equivalente Il pH della soluzione è determinato dal volume della base forte aggiunto in eccesso rispetto al volume necessario per arrivare al punto equivalente [OH-] =[ (V • 0,100 – 1,50)/ (15,0 + V)] ; pH = - log [H3O+]. [H3O+] = Kw/ [OH-] ; Calcoli V/ mL NaOH(aq) [H3O+] / M pH 0 0,100 1,00 5,00 0,0500 1,30 10,0 0,0200 1,70 14,7 0,001 3,00 14,8 6,70• 10-4 3,17 14,9 3,34 • 10-4 3,48 15,0 1,00 • 10-7 7,00 15,1 3,01 • 10-11 10,5 15,2 1,51 • 10-11 10,8 15,3 1,01 • 10-11 11,0 20,0 7,00 • 10-13 12,2 25,0 4,00 • 10-13 12,4 30,0 3,00 • 10-13 12,5 Senza uno strumento di misura del pH (il pH-metro) non possiamo ottenere la curva sperimentale del pH in funzione di V. Possiamo comunque determinare il punto equivalente con l’uso di un indicatore, in questo esempio utilizziamo il metil-arancio. Curva di titolazione Meccanismo d’azione dell’indicatore Un indicatore è in generale un acido debole di natura organica, per brevità indicato con HInd. Tale acido in soluzione si dissocia parzialmente nella specie anionica Ind- di colore diverso rispetto al colore della specie indissociata HInd: HInd + H2O(l) H3O+ + IndPer l’indicatore metil-arancio (cercare nel libro di testo la sua struttura) abbiamo Ka ≈ 10-4 = [H3O+] [Ind-]/ [HInd] = 10-pH [Ind-]/ [HInd] la specie Ind- è di colore giallo mentre la specie HInd è di colore rosso. L’occhio umano percepisce un colore netto quando la concentrazione delle specie colorate sono nel rapporto 1 a 10 oppure 10 a 1, cioè: soluzione di colore rosso [HInd] ≥ 10 [Ind-] cioè [Ind-]/[HInd] = 10(pH-4) ≤ 0,10 soluzione di colore giallo [Ind-] ≥ 10 [Hind] cioè [Ind-]/[HInd] = 10(pH-4) ≥ 10 Nella tabella seguente riportiamo il colore della soluzione in funzione del volume di base aggiunta, cioè del pH della soluzione. Assumendo di terminare l’aggiunta della base al valore di volume V indicato riportiamo anche l’errore assoluto e l’errore relativo che si commette nella titolazione. Gli errori sono definiti con le equazioni seguenti: errore assoluto = |1,50 – V • 0,100| errore relativo % =( |1,50 – V • 0,100|/1,50)•100 V/ mL pH colore della [Ind-]/[HInd] soluzione NaOH(aq) Errore assoluto/ Errore relativo % mmol 14,7 3,00 rossa 0,10 0,03 2 14,8 3,17 arancione 0,15 0,02 1,3 14,9 3,48 arancione 0,30 0,01 0,7 15,0 7,00 giallo 1000 0,00 0 15,1 10,5 giallo 3,16 •10 6 0,01 0,7 15,2 10,8 giallo 6,31 •10 6 0,02 1,3 15,3 11,0 giallo 10,0 •10 6 0,03 2 Dai dati riportati in tabella e dalla curva di titolazione si vede che l’errore commesso in una titolazione acido forte – base forte è legato essenzialmente alla difficoltà di cogliere il punto di viraggio dell’indicatore. Considerando che 1 goccia equivale a circa 0,05 mL di soluzione titolante l’errore è stimato dell'ordine dell’1% .
Scaricare