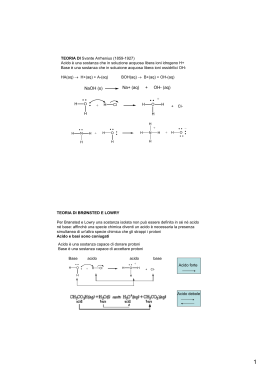
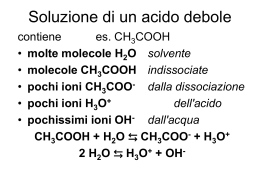
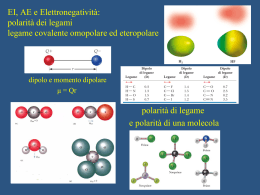
Dipartimento di Chimica Università di Roma “La Sapienza” Chimica Analitica 2 con Laboratorio Prof. Antonio Magrì OTTIMIZZARE Raggiungere uno scopo con il minimo sforzo CHIMICA ANALITICA disciplina scientifica preposta a dare risposta a specifici quesiti mediante l’analisi chimica: - Sviluppando ed applicando adeguate procedure - Valutando ed interpretando i risultati ottenuti Gli insegnamenti di Chimica Analitica (comuni a tutti gli orientamenti) - Chimica Analitica 1 con lab. (qualitativa) - Chimica Analitica 2 con lab. (quantitativa, metodi chimici) - Chimica Analitica 3 (principi generali e cenni di analisi chimica strumentale) hanno lo scopo di dare al laureato in Chimica i concetti basilari dell’analisi chimica Gli altri insegnamenti di Chimica Analitica (diversi in funzione dell’orientamento scelto) riprendono, ampliano ed approfondiscono le problematiche connesse all’analisi chimica anche attraverso specifiche applicazioni a sistemi reali al fine di far acquisire allo studente la necessaria “sensibilità analitica” capacità di ragionare ed operare in modo ordinato, sistematico, logico e sequenziale FARE un’analisi chimica non vuole dire (solo) ESEGUIRE ANALISI CHIMICA Approccio multivariato su un campione per ottenere le informazioni necessarie e sufficienti per la caratterizzazione del materiale di provenienza FASI di una ANALISI CHIMICA Conoscenza dello scopo dell’analisi z Campionamento z Scelta del metodo di analisi z Esecuzione della misura z Comunicazione del risultato z Un chimico (analitico) deve possedere la capacità di affrontare in modo critico le tecniche, i metodi ed i procedimenti di analisi PROGRAMMA DEL CORSO Accuratezza (errori sistematici) e precisione (errori casuali) nell’analisi chimica quantitativa. · Il laboratorio di analisi chimica quantitativa classica: reattivi, vetreria, apparecchiature di base. · La bilancia analitica: modalità di pesata; cause di errori nella pesata. · Principi elementari di campionamento. · I principi dell’analisi volumetrica: la titolazione (uso della buretta e modalità di esecuzione); preparazione di soluzioni standard (calcolo e/o determinazione del loro titolo). · Titolazioni acidimetriche ed alcalimetriche: calcolo e costruzione delle curve di titolazione acido-base; indicatori acido-base e loro scelta; condizioni di titolabilità ed errore di titolazione; soluzioni standard nelle titolazioni acido-base. Esempi ed applicazioni in laboratorio. · Titolazioni con formazione di precipitato: calcolo delle curve di titolazione argentometriche; indicatori e loro scelta; condizioni di titolabilità ed errore di titolazione; soluzioni standard nelle titolazioni argentometriche. Esempi ed applicazioni in laboratorio. · Titolazioni complessometriche: equilibri di complessazione e costanti condizionali; l’acido etilendiamminotetraacetico (EDTA); calcolo delle curve di titolazione chelometriche; indicatori metallocromici e loro scelta; condizioni di titolabilità ed errore di titolazione; soluzioni standard nelle titolazioni chelometriche. Esempi ed applicazioni in laboratorio. · Titolazioni di ossido-riduzione: equilibri di ossido-riduzione e potenziali formali; calcolo delle curve di titolazione redox; scelta dell’indicatore (redox o “specifico”); condizioni di titolabilità ed errore di titolazione; soluzioni standard nelle titolazioni redox. Esempi ed applicazioni in laboratorio. · I principi dell’analisi gravimetrica: teoria della precipitazione; fattori che influenzano la solubilità di un precipitato; fattori che influenzano la purezza di un precipitato; scelta delle condizioni e delle modalità operative; calcoli ed errori nell’analisi gravimetrica. Esempi ed applicazioni in laboratorio. ------------Testi consigliati Bottari, Festa “Laboratorio di Chimica Analitica Quantitativa” Kolthoff, Sandell, Mehan, Bruckenstein “Analisi Chimica Quantitativa” - CAMPIONAMENTO Insieme di operazioni atte al prelievo di un campione rappresentativo dell’intera massa Alcune valutazioni da fare per scegliere metodo e strumenti più adatti Scopo dell’analisi Grado di omogeneità del campione Accuratezza, tempo e costo massimo ammissibili Stato fisico del campione Metodi Ufficiali di Campionamento Organizzazioni scientifiche specializzate curano la messa a punto di metodi di campionamento per specifici campioni e/o particolari analisi p.es. Annual Book of ASTM Standards (part 31 – WATER) Sampling and Flow Measurements Sampling Equipment Sampling Boil Water Sampling Particulate Ion Exchange Materials Sampling Steam Sampling Waste Water Sampling Water for a) Chemical and Physical Tests : b) Biological tests ; c) Radioactive Detarmination ; d) Continual Analysis SCELTA del METODO di ANALISI Valutazioni da fare per scegliere quello più adatto Scopo dell’analisi Natura del campione Accuratezza, precisione, tempi, costi Sensibilità, limite di rivelabilità e di quantitativa Numero, frequenza e luogo di analisi Strumentazione disponibile Quantità di analita Selettività Classificazione dei Metodi di Analisi In base della quantità di campione richiesta Macro ………………………………… W > 0,1 g Meso (semimicro) ………..… 0,01 g < W < 0,1 g Micro ………………………………….. W < 0,01 g In base della concentrazione dell’analita Major ………………………………… C > 1 % Minor……………………..… 0,01 % < C < 1 % Tracce…………………………………. C < 0,01 % Selettività dei Metodi di Analisi Scelta della proprietà (chimica o fisica) da misurare Ricerca ed eliminazione delle interferenze Trasformazione dell’analita in forma misurabile Separazione fisica dell’analita delle specie interferenti Metodi STANDARD di Analisi controllati e validati da organizzazioni scientifiche specializzate ASTM (American Society for Testing and Materials) API (American Petroleum Institute) APHA (American Public Health Association) AOAC (Association of Official Analytical Chemists) ISO (International Organization for Standardization) IRSA (Istituto di Ricerca sulle Acque) LA MISURA Può presentare qualche difficoltà dal punto di vista tecnico Complessità della strumentazione utilizzata Abilità manuale dell’operatore COMUNICAZIONE del RISULTATO Il risultato numerico deve esprimere esattamente quanto trovato con l’analisi chimica né più né meno N (numero di analisi ripetute sullo stesso campione) Xmedio (media aritmetica delle N determinazioni) S (stima dell’incertezza associata al risultato espresso) Analisi Chimica QUANTITATIVA METODI CLASSICI Volumetrici Gravimetrici STRUMENTALI EQUILIBRIO CHIMICO ASPETTO Cinetico (bilanciamento dinamico) correlato con il meccanismo della reazione Energetico (composizione costante) correlato con lo stato di massima stabilità Costante di equilibrio termodinamica e di concentrazione k K (o di attività) dipende soltanto dalla temperatura dipende dalla temperatura e dalla forza ionica L’attività è correlata alla concentrazione tramite il coefficiente di attività (ax = fx [x]) calcolabile (nei casi più semplici) dall’espressione logf = -Az2√μ (legge limite di Debye-Huckel) (dove μ = ½ Σ cizi2 è la forza ionica della soluzione) Per esempio : A+B ⇆ C+D a C ⋅ aD fC ⋅ fD [C] ⋅ [D] fC ⋅ fD K= = = k a A ⋅ aB fA ⋅ fB [A ] ⋅ [B] fA ⋅ fB ANALISI VOLUMETRICA BASI Misura del volume di un reattivo, a concentrazione esattamente nota, aggiunto fino al raggiungimento del punto di equivalenza CONDIZIONI di APPLICABILITA’ Reazione: istantanea, completa, unica, univoca e a stechiometria nota REAZIONI UTILIZZATE Combinazione di ioni Trasferimento di elettroni Metodi Volumetrici DIRETTI Mg2+ + Y4- ⇆ [MgY]2- INDIRETTI CaCl(OCl) + 2H+ ⇆ Cl2 + H2O Cl2 + 2I- ⇆ 2Cl- + I2 I2 + 4S2O32- ⇆ 2I- + 2S4O62- RETROTITOLAZIONI Zn2+ + Y4- ⇆ [ZnY]2- + Y4Mg2+ + Y4- ⇆ [MgY]2- TITOLAZIONE Preparazione delle soluzioni titolanti Titolo calcolato (standard primario) Titolo determinato (standardizzazione) Norme pratiche di titolazione La buretta: scelta, pulizia, controlli, avvinamento, etc. Velocità di flusso della soluzione titolante Agitazione della soluzione titolata Errore di titolazione ε = Ve - V f Indicatori Cromatici Sostanze che modificano il loro colore in funzione della concentrazione di una determinata specie presente in soluzione Esempio Indicatori acido-base Indicatori metallocromici Indicatori redox pH pM E Indicatori Acido-Base Acidi (o basi) deboli che hanno un colore molto diverso a secondo della “forma” in cui si trovano HIn + H2O ⇆ In- + H3O+ pH = p(ka)m + log ([In-]/[HIn]) Punto di viraggio pHv = p(ka)m Intervallo di viraggio pHv = p(ka)m ± 1 Indicatori misti e indicatori schermati Scelta dell’indicatore p(ka)m – 1 < pHequiv < p(ka)m + 1 L’uso di indicatori cromatici presuppone la conoscenza della curva teorica di titolazione Scelta del Punto di Arresto Equilibri acido-base Definizione di Bronsted - Lowry Acido Base (sostanza che può cedere protoni) (sostanza che può acquistare protoni) coppia coniugata acido-base a1 ⇆ b1 + H+ coppia coniugata base-acido b2 + H+ ⇆ a2 Reazione acido-base a1 + b2 ⇆ b1 + a2 Esempi di coppie coniugate acido-base Specie molecolari anioni cationi Acido Base HCl Cl- HNO3 NO3- H3PO4 H2PO4- H2PO4- HPO42- HCO3- CO32- HSO4- SO42- NH4+ NH3 Feaq3+ Feaq(OH)2+ C6H5NH3+ C6H5NH2 H2O solvente anfiprotico H2O + H2O ⇆ H3O+ + OHKw = aH3O+ aOH= 1 10-14 mol2/L2 kw = [H3O+ ] [OH-] = 1 10-14 mol2/L2 Le specie che cedono protoni all’acqua sono chiamate “acidi”, quelle che li acquistano “basi” La loro maggiore o minore capacità di cessione/acquisto del protone è chiamata”forza” dell’acido o della base Questa forza è “misurata” dal valore della costante di equilibrio Costanti di equilibrio (di un acido e della sua base coniugata) HA + H2O ⇆ A- + H3O+ A- + H2O ⇆ HA + OH- ka = ([A-] [H3O+])/[HA] kb = ([HA] [OH-])/[A-] ka kb= ([A-][H3O+][HA][OH-])/([HA][A-]) = kw Costanti di acidi monoprotici e delle loro basi coniugate Specie ac. acetico ione ammonio ac. cianidrico ac. benzoico ac. cloroacetico ac. dicloracetico ac. formico ac. fluoridrico ac. ipocloroso pka pkb 4,65 9,35 9,37 4,63 9,2 4,8 4,1 9,9 2,7 11,3 1,1 12,9 3,65 10,35 3,05 10,95 7,04 6,96 Costanti di acidi diprotici Specie ac. carbonico ac. solfidrico ac. solforoso ac. amminoacetico ac. malonico ac. ossalico ac. ftalico ac. salicilico ac. tartarico pka,1 pka,2 6,3 9,1 6,9 12,6 1,8 6,8 2,5 9,7 2,7 5,4 1,1 4,0 2,8 5,1 2,8 13,1 2,9 4,1 Curve di titolazione acido-base Sono costruite riportando in ordinate il pH della soluzione (var. dipendente) e in ascisse il vol. di titolante aggiunto (var. indipendente) Nelle titolazioni con indicatore cromatico è necessario conoscere “a priori” la curva di titolazione teorica per: valutare la possibilità di analisi scegliere l’indicatore più adatto calcolare l’errore di titolazione Calcolo di una curva di titolazione (acido-base) è necessario conoscere quale acido (o base) si vuole titolare e la sua concentrazione analitica per ogni aggiunta di titolante si calcola il pH della soluzione impostando e risolvendo un sistema di N equazioni (per N incognite) Titolazione acido forte Calcolo pH spontaneo (acido forte da solo) H2O + H2O ⇆ H3O+ + OH- HB + H2O ⇆ B- + H3O+ 3 incognite – 3 equazioni indipendenti [B-] = Ca ; [H3O+][OH-] = kw ; [H3O+] = [OH-] + [B-] Risoluzione esatta del sistema [H 3O + ] = Soluzioni approssimate (< 1%) Se Ca > 100 [OH-] [H3O+] = Ca Se Ca < 0,0 1[OH-] [H3O+] = [OH-] Ca + Ca2 + 4k w 2 Titolazione acido forte Calcolo pH prima del punto di equivalenza (acido forte + il suo sale sodico) H2O + H2O ⇆ H3O+ + OHNaB + H2O HB + H2O ⇆ B- + H3O+ Na+ + B- + H2O 4 incognite – 4 equazioni indipendenti [Na+]= Cs ; [B-] = Ca+ Cs ; [H3O+][OH-] = kw ; [Na+]+[H3O+] = [OH-]+[B-] Risoluzione esatta del sistema [H 3O + ] = Soluzioni approssimate (< 1%) Se Ca > 100 [OH-] Se Ca < 0,0 1[OH-] [H3O+] = Ca [H3O+] = [OH-] Ca + Ca2 + 4k w 2 Titolazione acido forte Calcolo pH al punto di equivalenza (sale sodico dell’acido forte) H2O + H2O ⇆ H3O+ + OH- NaB + H2O ⇆ Na+ + B- + H2O 4 incognite – 4 equazioni indipendenti [Na+] = Cs ; [B-] = Cs ; [H3O+][OH-] = kw ; [Na+]+[H3O+] = [OH-]+[B-] Risoluzione esatta del sistema pH = 7 [H3O+] = [OH-] Titolazione acido forte Calcolo pH dopo il punto di equivalenza (sale sodico dell’acido forte + NaOH) H2O + H2O ⇆ H3O+ + OHNaOH + H2O NaB + H2O ⇆ Na+ + B- + H2O Na+ + OH- +H2O 4 incognite – 4 equazioni indipendenti [Na+]= Cs+Cb ; [B-] = Cs ; [H3O+][OH-] = kw ; [Na+]+[H3O+] = [OH-]+[B-] Risoluzione esatta del sistema [OH − ] = Soluzione approssimata (< 1%) Se Cb > 100 [H3O+] [OH-] = Cb Cb + Cb2 + 4k w 2 [H3O+] = kw /[OH-] Titolazione acido forte Calcolo della curva di titolazione teorica (approssimazione < 1%) se 0 ≤ Vb < Ve e se [H3O+] > 1 10-6 se Vb = Ve se Vb > Ve e se [H3O+] < 1 10-8) [H 3O + ] = Ca* [H 3O + ] = kw [H 3O ] = + dove : C = * a CaVa − CbVb Va + Vb C = * b Cb (Vb − Ve ) Va + Vb kw Cb* Titolazione acido forte Effetto della concentrazione sulla titolabilità Titolazione HCl con NaOH (le concentrazioni di HCl e NaOH sono identiche) 14 12 0.0001 M 0,001 M 0,01 M 10 pH 8 6 4 2 0 0,00 10,00 20,00 30,00 mL titolante 40,00 50,00 Titolazione acido debole (monoprotico) Calcolo pH spontaneo (acido debole da solo) H2O + H2O ⇆ H3O+ + OH- HB + H2O ⇆ B- + H3O+ 4 incognite – 4 equazioni indipendenti [HB]+[B-] = Ca [H3O+][OH-] = kw ; ; [H3O+] = [OH-] + [B-] ([H3O+][B-])/[HB] = ka Risoluzione esatta del sistema [H3O+]3 + ka [H3O+]2 - (kaCa+kw)[H3O+] – kwka = 0 Titolazione acido debole monoprotico Calcolo pH spontaneo (acido debole da solo) Risoluzione esatta in forma implicita [H 3O + ] = ka Ca − ([H 3O + ] − [OH − ]) ([H 3O + ] − [OH − ]) Soluzioni approssimate (< 1%) Se [H3O+] > 100 [OH-] [H3O+]2 + ka[H3O+] - kaCa = 0 Se anche Ca > 100 [H3O+] [H3O+]2 = kaCa Titolazione acido debole monoprotico Calcolo pH prima del punto di equivalenza (acido debole + il suo sale sodico) H2O + H2O ⇆ H3O+ + OH- HB + H2O ⇆ B- + H3O+ Na+ + B- + H2O NaB + H2O 5 incognite – 5 equazioni indipendenti [Na+]=Cs ; [HB]+[B-] = Ca+Cs ; [Na+]+[H3O+] = [OH-]+[B-] [H3O+][OH-] = kw ; ([H3O+][B-])/[HB] = ka Risoluzione esatta del sistema [H3O+]3 + (ka+Cs)[H3O+]2 - (kaCa+kw)[H3O+] – kwka = 0 Titolazione acido debole monoprotico Calcolo pH prima del punto di equivalenza (acido debole + il suo sale sodico) Risoluzione esatta in forma implicita [H 3O + ] = ka Ca − ([H 3O + ] − [OH − ]) Cs + ([H 3O + ] − [OH − ]) Soluzioni approssimate (< 1%) Se [H3O+] > 100 [OH-] Se anche Ca > 100 [H3O+] e Cs > 100 [H3O+] [H3O+]2 + (Cs+ka)[H3O+] - kaCa = 0 [H3O+] = kaCa/Cs Titolazione acido debole monoprotico Calcolo pH al punto di equivalenza (sale sodico dell’acido debole) H2O + H2O ⇆ H3O+ + OH- NaB + H2O Na+ + B- + H2O B- + H2O ⇆ HB + OH- 5 incognite – 5 equazioni indipendenti [Na+]=Cs ; [HB]+[B-] = Cs ; [Na+]+[H3O+] = [OH-]+[B-] [H3O+][OH-] = kw ; ([H3O+][B-])/[HB] = ka Risoluzione esatta del sistema [H3O+]3 + (ka+Cs)[H3O+]2 - kw[H3O+] – kwka = 0 Titolazione acido debole monoprotico Calcolo pH al punto di equivalenza (sale sodico dell’acido debole) Risoluzione esatta in forma implicita − + [ ] [ ] OH − H O 3 + [H 3O ] = ka Cs − ([OH − ] − [H 3O + ]) Soluzioni approssimate (< 1%) Se [OH-] > 100 [H3O+] Se anche Cs > 100 [OH-] Cs[H3O+]2 - kw[H3O+] - kakw = 0 [H3O+]2 = kakw /Cs Titolazione acido debole monoprotico Calcolo pH dopo il punto di equivalenza (sale sodico dell’acido debole + NaOH) NaB + H2O H2O + H2O ⇆ H3O+ + OHNaOH + H2O B- + H2O ⇆ HB + OH- Na+ + B- + H2O Na+ + OH- +H2O 5 incognite – 5 equazioni indipendenti [Na+]=Cs+Cb ; [HB]+[B-] = Cs ; [Na+]+[H3O+] = [OH-]+[B-] [H3O+][OH-] = kw ; ([H3O+][B-])/[HB] = ka Risoluzione esatta del sistema [H3O+]3 + (ka+Cs+Cb)[H3O+]2 – (kw-Cb)[H3O+] – kwka = 0 Titolazione acido debole monoprotico Calcolo pH dopo il punto di equivalenza (sale sodico dell’acido debole + NaOH) Risoluzione esatta in forma implicita − + ( [ ] [ ]) − Cb OH H O − 3 + [H 3O ] = ka Cs + Cb − ([OH − ] − [H 3O + ]) Soluzioni approssimate (< 1%) Se [OH-] > 100 [H3O+] (Cs+Cb)[H3O+]2 + (kaCb - kw)[H3O+] - kakw = 0 Per un’ulteriore approssimazione conviene riconsiderare le relazioni: [Na+]+[H3O+] = [OH-]+[B-] ; [Na+]=Cs+Cb ; [HB]+[B-] = Cs Se anche [B-] > 100 [HB] [OH-]= Cb [H3O+] = kw /Cb Titolazione acido debole monoprotico Calcolo della curva di titolazione teorica (approssimazione < 1%) [H 3O + ] = se Vb = 0 ; [H3O+] > 1 10-6 ; Ca > 100 [H3O+] se 0 < Vb < Ve ; [H3O+] Cs > 100 [H3O+] >1 10-6 ; Ca* > 100 [H3O+] se Vb = Ve ; [H3O+] < 1 10-8 ; Cs > 100 [OH-] k a Ca [H 3O + ] = ka ; [H 3O ] = + se Vb > Ve ; [H3O+] < 1 10-8 ; ka > 100 [H3O+] ka C = Ca Va − C b Vb Va + Vb C = * b C b (Vb − Ve ) Va + Vb Cs = Cs kw Cs kw + [H 3O ] = * Cb dove : * a Ca* C b Vb Va + Vb Titolazione acido debole monoprotico Effetto della forza dell’acido sulla sua titolabilità Titolazione di acidi deboli monoprotici (concentrazioni titolante e titolato 0.01 M) 14 12 pka = 6 pka = 4 pka = 2 10 pH 8 6 4 2 0 0,00 10,00 20,00 30,00 mL titolante 40,00 50,00
Scaricare