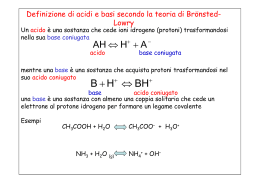
TEORIA DI Svante Arrhenius (1859-1927) Acido è una sostanza che in soluzione acquosa libera ioni idrogeno H+ Base è una sostanza che in soluzione acquosa libera ioni ossidrilici OHHA(aq) → H+(aq) + A-(aq) BOH(aq) → B+(aq) + OH-(aq) Na+ (aq) NaOH (s) + OH- (aq) + H O H + H Cl O H H + Cl- H O H H _ + H H H + N H O N + H H H H TEORIA DI BRØNSTED E LOWRY Per Brønsted e Lowry una sostanza isolata non può essere definita in sé né acido né base: affinché una specie chimica diventi un acido è necessaria la presenza simultanea di un'altra specie chimica che gli strappi i protoni Acido e basi sono coniugati Acido è una sostanza capace di donare protoni Base è una sostanza capace di accettare protoni Base acido acido base + H O H + H Cl H O H Acido forte + Cl- H Acido debole 1 Forza reciproca di coppie acido-base coniugate Acido fortebase debolissima Acido debolebase debole Acido debolissimobase forte _ 2 Posizione dell’equilibrio quando l’acido o la base non sono in acqua Acido più forte + Base più forte Acido più debole + Base più debole Per valutare chi sono la coppia acido e base più forti si usano le pKa LA TEORIA DI LEWIS Acido: qualsiasi composto in grado di accettare un doppietto di elettroni per formare un legame dativo Base: qualsiasi composto in grado di cedere un doppietto elettronico per formare un legame dativo 3 Misura di acidità e basicità Acido forte o base forte: in acqua sono completamente ionizzati HCl, HBr, H2SO4, ….. NaOH, LiOH, Ca(OH)2,…. H2O H+ + OH- [H+]·[OH-] —————— = Kc Kc, alla temperatura di 25 °C, vale 1,8·10-16 (moli/litro). [H2O] [H3O+] = [OH-] = 1,0 · 10-7 mol/L HA + H2O A- + H3O+ [A-] · [H3O+] ———————— = Kc [HA] · [H2O] Se consideriamo costante la concentrazione dell'acqua: [A-] · [H3O+] ———————— = Ka [HA] Ka si chiama costante di dissociazione acida e si osserva che quanto maggiore è il suo valore tanto più forte è l'acido Per le basi B + H2O HB+ + OH- [HB+] · [OH-] ———————— = Kb [B] Si dimostra che per le coppie acido-base coniugata vale la seguente relazione: Ka · Kb = Kw IL CONCETTO DI pH pH = - log [H+] pOH = - log [OH-] 4 Esempi di pH di composti comuni e fluidi fisiologici Acidità ed elettronegatività lungo il 2° periodo relative electronegativities C < N < O < F 5 Acidità ed elettronegatività degli acidi alogenidrici Apparentemente l’acidità è contraria alla elettronegatività In realtà si deve tener conto della maggior forza del legame H-F rispetto ad H-I Il legame H-F è più forte di H-I per la scarsa sovrapposizione orbitalica in quest’ultimo. La carica negativa di H- è più dispersa che in F- 6 Acidità e risonanza CH3CH2-OH + H2O CH3CH2-O- + H3O+ O H3C C pKa = 15.9 O + H2O H3C + H3O C + _ OH O _ O H3C C O pKa = 4.8 L’acidità è legata alla dispersione della carica negativa per effetto induttivo pKa = 4.8 O H3C C O + H2O H3 C + H3O C + _ OH O pKa = 0.2 O F3C C O + OH H2O F3C + H3O C + _ O 7
Scaricare