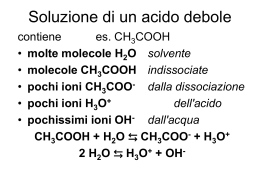
IL pH DI SOLUZIONI DI ACIDI DEBOLI Si voglia, ad esempio, calcolare il pH di una soluzione di un acido debole (H2CO3) in funzione della sua concentrazione (Ca) e della sua forza (Ka). Per l’equilibrio di dissociazione: H3O+ + HCO3- H2CO3 + H2O vale la relazione: Ka = [H3O+] [HCO3- ] [H2CO3 ] Ad equilibrio raggiunto sarà: [H3O+] [HCO3- ] poichè si formano un parti uguali dalla dissociazione (trascurando gli H3O+ provenienti da H2O) [H2CO3] Ca poichè l’acido è debole e l’equilibrio è pressochè spostato a sinistra Ka [H3O+]2 Elementi di Chimica e Biochimica Rita Roberti, Giovanni Alunni Bistocchi da cui [H3O+] Ka Ca Ca Copyright © 2007 – The McGraw-Hill Companies s.r.l.
Scaricare