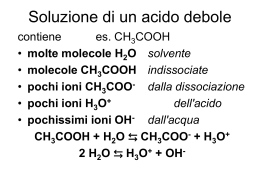
Lezione 5 Reazioni acido-base Acidi e Basi Definizione di Arrhenius (1887): acidi e basi sono composti che in acqua danno luogo a dissociazione elettrolitica: Svante August Arrhenius Wijk (Svezia), 1859 – Stoccolma, 1927 Acido H+(aq) + ... Base OH-(aq) + ... Insufficienza della definizione di Arrhenius: Molte basi, come per esempio NH3, non possono formare OH-(aq) per semplice dissociazione elettrolitica. La reazione acido-base deve essere di tipo diverso. Definizione di Brønsted e Lowry (per acidi e basi in soluzioni acquose) Acido = donatore di protoni Base = accettore di protoni 2 H2O(l) ⇄ H3O+(aq) + OH-(aq) K w [H3O ] [OH ] A 25°C si ha Kw = -14 10 “coppie acido-base coniugati” ione nitrito acido nitroso ione idrossonio HNO2(aq) + H2O(l) ⇄ NO2-(aq) + H3O+(aq) acido 1 base 2 base 1 acido 2 ione ammonio ammoniaca ione ossidrile NH3(aq) + H2O(l) ⇄ NH4+(aq) + OH-(aq) base 1 acido 2 acido 1 base 2 HClO2(aq) + H2O(l) ⇄ ClO2-(aq) + H3O+(aq) 2 [ClO ] [H3O ] Ka [HClO 2 ] N2H2(aq) + H2O(l) ⇄ N2H3+(aq) + OH-(aq) 3 [ N 2 H ] [OH ] Kb [ N 2H 2 ] 2 H2O(l) ⇄ H3 + O (aq) K w [H3O ] [OH ] + OH (aq) A 25°C si ha Kw = 10-14 Soluzione neutra: [H3O+] = [OH-] Soluzione acida: [H3O+] > [OH-] Soluzione basica: [H3O+] < [OH-] K w [H 3O ] [OH ] Soluzione neutra: [H3O ] [OH ] K w Soluzione acida: [H3O ] K w ;[OH ] K w Soluzione basica: [H3O ] K w ;[OH ] K w a 25°C [H3O+] > [OH-] [H3O+] 10 0 Kw [H3O+] < [OH-] 10-1 10-2 10-3 10-4 10-5 10-6 10-7 10-8 10-9 10-10 10-11 10-12 10-13 10-14 soluzione acida soluzione basica [H3O+] > 10-7 M [OH-] < 10-7 M soluzione neutra [H3O+] = [OH-] = 10-7 M [H3O+] < 10-7 M [OH-] > 10-7 M Sostanze di uso quotidiano Pioggia Aceto pH 0 1 2 3 4 Succo d’arancio 5 6 Sangue 7 8 9 10 11 12 13 14 Latte Ammoniaca per uso domestico Carenze della teoria di Brønsted e Lowry : Vi sono alcune sostanze che portano ad una variazione del pH di una soluzione senza accettare o donare protoni. Serve un modello più generale di cui gli altri modelli sono dei casi speciali. Definizione di Lewis Acido = accettore di una coppia di elettroni Base = donatore di una coppia di elettroni a 25°C pOH log 10[OH ] pH log 10[H 3O ] pH > pOH pH < pOH pH 0 1 2 3 4 5 6 7 8 9 10 11 12 13 14 soluzione acida soluzione basica pH < 7 pOH > 7 soluzione neutra pH > 7 pOH < 7 pH = pOH = 7 Cambiando temperatura, come variano le condizioni di pH? H3 + O (aq) + OH (aq) ⇄ 2 H2O(l) 1 1 K K w [H 3O ] [OH ] H° < 0 2 H2O(l) ⇄ H3O+(aq) + OH-(aq) K w [H 3O ] [OH ] H° > 0 T > 25°C 25°C 10-13 lnKw H° > 0 10-14 10-15 10-16 T < 25°C 1/T 1/T Soluzione neutra: [H3O ] [OH ] K w ; pH log 10 K w A 25°C: pH = 7; a T < 25°C: pH > 7; a T > 25°C: pH < 7 T( °C) 0 10 20 25 30 40 50 60 Kw 1,14 x 10-15 2,92 x 10-15 6,81 x 10-15 1,01 x 10-14 1,47 x 10-14 2,92 x 10-14 5,47 x 10-14 9,61 x 10-14 pH 7,47 7,27 7,08 7,00 6,92 6,77 6,63 6,51 Acido debole (Ka < 1) in concentrazione ca HA(aq) + H2O(l) ⇄ A-(aq) + H3O+(aq) (ca – x) x x [A ] [H3O ] Ka [HA ] x2 Ka (c a x ) Se l’acido è così debole che x << ca, allora: [H 3O ] [A ] Ka ca Base debole (Kb < 1) in concentrazione cb B(aq) + H2O(l) ⇄ BH+(aq) + OH-(aq) (cb – x) x x [BH ] [OH ] Kb [B] x2 Kb (c b x ) Se la base è così debole che x << cb, allora: [OH ] [BH ] K bcb IDROLISI DEI SALI (reazioni acido base degli ioni formati per dissociazione elettrolitica) NaCl(s) Na+(aq) + Cl-(aq) in acqua non dà reazioni acido-base Cl- è la base coniugata di HCl, ma quest’ultimo è un acido così forte che Cl- è una base con forza praticamente nulla NaNO2(s) Na+(aq) + NO2-(aq) NO2- è la base coniugata di HNO2, e quest’ultimo è un acido debole quindi… HNO2(aq) + H2O(l) ⇄ NO2-(aq) + H3O+(aq) [ NO2 ] [H 3O ] Ka [HNO 2 ] NO2-(aq) + H2O(l) ⇄ HNO2(aq) + OH-(aq) [HNO 2 ] [OH ] Kb [ NO2 ] IDROLISI BASICA NH4Cl(s) NH4+(aq) + Cl(aq) NH4+ è l’acido coniugato di NH3, e quest’ultimo è una base debole quindi… NH3(aq) + H2O(l) ⇄ NH4+(aq) + OH-(aq) NH4+(aq) + H2O(l) ⇄ NH3(aq) + H3O+(aq) IDROLISI ACIDA 4 [ NH ] [OH ] Kb [ NH3 ] [ NH3 ] [H3O ] Ka [ NH4 ] In tutti i casi, per una coppia acido-base coniugati si ha: Ka Kb = Kw Per esempio, per NH4+-NH3: [ NH4 ] [OH ] Kb [ NH3 ] [ NH3 ] [H3O ] Ka [ NH4 ] [ NH4 ] [OH ] [ NH3 ] [H3O ] Ka Kb [ H O ][ OH ] Kw 3 [ NH3 ] [ NH4 ] Riepilogo: Acido debole: [H3O ] Ka ca Base debole: [OH ] K bcb Idrolisi acida: [H 3O ] Idrolisi basica: [OH ] Kw cs Kb Kw cs Ka Quando in una soluzione sono presenti sia un acido debole che la sua base coniugata… per esempio: HClO(aq) + H2O(l) ⇄ ClO-(aq) + H3O+(aq) cb ca con ca e cb in quantità paragonabili [ClO ] [H3O ] (cb x ) x Ka [HClO ] (c a x ) c b [ H 3O ] ca Ka ; [ H 3O ] K a se x << ca e x << cb ca cb Un soluzione con un acido debole e la sua base coniugata, con ca e cb in quantità paragonabili, è un tampone. Per esempio: NH3(aq) + H2O(l) ⇄ NH4+(aq) + OH-(aq) ca cb L’aggiunta di una piccola quantità di acido sposta la reazione a destra L’aggiunta di una piccola quantità di base sposta la reazione a sinistra Il pH non cambia molto in ambedue i casi Riepilogo: Tampone formato da un acido debole e la ca sua base coniugata: [H 3O ] K a cb Tampone formato da una base debole e il cb suo acido coniugato: [OH ] K b ca INDICATORI DI pH HA(aq) + H2O(l) ⇄ A-(aq) + H3O+(aq) rosso giallo [ A ] [ H 3O ] Ka [HA ] [H 3O ] [HA ] giallo Ka [A ] rosso [H3O ] [HA ] giallo Ka [A ] rosso Quando [H3O+] >> Ka la soluzione appare gialla Quando [H3O+] << Ka la soluzione appare rossa Quando [H3O+] Ka la soluzione appare arancione pKa = - log10 Ka pH 0 Rosso cresolo 1 2 3 giallo 4 5 6 arancio 7 8 rosso 9 10 11 12 13 14 Indicatori 0 Metilarancio Timolftaleina Verde di cresolo Fenoftaleina Rosso di metile 1 2 3 4 5 6 7 8 9 10 11 12 13 14 ACIDI POLIPROTICI H3PO4(aq) + H2O(l) ⇄ H2PO4-(aq) + H3O+(aq) K1 = 7,1×10-3 H2PO4-(aq) + H2O(l) ⇄ HPO42-(aq) + H3O+(aq) K2 = 6,2×10-8 HPO4-(aq) + H2O(l) ⇄ PO43-(aq) + H3O+(aq) K3 = 4,4×10-13 H2CO3(aq) + H2O(l) ⇄ HCO3-(aq) + H3O+(aq) K1 = 4,7×10-7 HCO3-(aq) + H2O(l) ⇄ CO32-(aq) + H3O+(aq) K2 = 4,7×10-11 H2SO4(aq) + H2O(l) ⇄ HSO4-(aq) + H3O+(aq) K1 = ~102 HSO4-(aq) + H2O(l) ⇄ SO42-(aq) + H3O+(aq) K2 = 1,2×10-2 EQUILIBRI DI SOLUBILITÀ Esempio di elettroliti forti (si dissociano completamente in ioni) molto solubili: NaCl(s) Na+(aq) + Cl-(aq) KOH(s) K+(aq) + OH-(aq) Esempio di elettroliti forti poco solubili: AgCl(s) ⇄ Ag+(aq) + Cl-(aq) CaCO3(s) ⇄ Ca2+(aq) + CO32-(aq) Ni(OH)2(s) ⇄ Ni2+(aq) + 2 OH-(aq) Ca3(PO4)2(s) ⇄ 3 Ca2+(aq) + 2 PO43-(aq) CaCO3(s) ⇄ Ca2+(aq) + CO32-(aq) 2 2 K ps [Ca ] [CO3 ] a 25°C Kps = 8,7×10-9 Ag2CO3(s) ⇄ 2 Ag+(aq) + CO32-(aq) 2 2 K ps [Ag ] [CO3 ] a 25°C Kps = 6,2×10-12 Fe(OH)3(s) ⇄ Fe3+(aq) + 3 OH-(aq) 3 3 K ps [Fe ] [OH ] a 25°C Kps = 1,1×10-36 Solubilità = concentrazione del soluto che si scioglie nella soluzione, all’equilibrio, ad una certa temperatura. Solubilità (s, in mol L-1) in acqua pura: Ag2CO3(s) ⇄ 2 Ag+(aq) + CO32-(aq) 2s 2 K ps [Ag ] s 3 2 [CO3 ] 6 , 2 10 3 4 4 K ps s (2s) s 4s 12 2 3 1,16 10 4 a 25°C Solubilità in acqua pura: CaCO3(s) ⇄ Ca2+(aq) + CO32-(aq) s K ps [Ca s 2 s 2 ] [CO3 ] K ps 8,7 10 9 s 2 9,3 10 5 a 25°C Fe(OH)3(s) ⇄ Fe3+(aq) + 3 OH-(aq) s Solubilità a 25°C in acqua pura: 3s K ps s(3s) 9s 3 4 36 K 1,110 ps 4 s 4 5,9 1011 9 9 Solubilità a 25°C 10 3 30 -10: in [OH-]=10 K s ( 10 ) s 10 ps s K ps 1030 1,11036 6 1,110 30 10
Scaricare