Acidi e Basi
Acido è una parola che deriva dal latino
“acetum” (aceto). Col tempo la parola si è
estesa a tutte le sostanze che hanno un analogo
sapore “acidulo”.
Basi o alcali (dall’arabo al kali = la cenere
delle piante) sono le sostanze in grado di
neutralizzare gli acidi.
Lavoisier pensava che un acido
fosse caratterizzato da molecole
contenenti ossigeno
(oxys genes = generatore d’acido).
Antoine Lavoisier
1743-1794
Nel 1810 Humphry Davy dimostrò che
l’acido cloridrico (detto allora
muriatico) era formato solo da cloro e
idrogeno. Da allora fu accettata l’idea
che gli acidi fossero caratterizzati
dalla presenza d’idrogeno nella
molecola.
Humpry Davy
1778-1829
Definizione di Arrhenius (1887)
acidi e basi sono composti che in
acqua danno luogo a dissociazione
elettrolitica liberando
rispettivamente ioni H+ e OH-:
Acido H+(aq) + ...
Base OH-(aq) + ...
Svante August Arrhenius
Wijk (Svezia), 1859 – Stoccolma, 1927
Premio Nobel per la Chimica 1903
Neutralizzazione acido-base:
H+(aq) + OH-(aq) H2O(l)
Un acido ed una base si dicono forti quando sono
completamente dissociati .
Le reazioni di neutralizzazione sono reazioni tra acidi e basi:
HCl + KOH
KCl + H2O
che in forma ionica si può esprimere:
H+(aq) + Cl-(aq) + K+(aq) + OH-(aq)
K+(aq) + Cl-(aq) + H2O
che semplificata equivale a
H+(aq) + OH-(aq)
H2O (equazione ionica netta)
Il concetto di Arrhenius non si può applicare in
solventi diversi dall’acqua.
Insufficienza della definizione di
Arrhenius:
Molte basi, come per esempio
l’ammoniaca, NH3, non possono
formare OH-(aq) per dissociazione
elettrolitica. La reazione acido-base
deve essere quindi di tipo diverso.
Definizione di
Brønsted e Lowry (1923)
(per acidi e basi in soluzione acquosa)
Johannes Nicolaus Brønsted
1879-1947
Thomas Martin Lowry
1874-1936
Acido = donatore di protoni, H+
Base = accettore di protoni, H+
“coppie acido-base coniugati”
ione
nitrito
acido
nitrico
ione idronio
HNO3(aq) + H2O(l) ⇄ NO2-(aq) + H3O+(aq)
acido 1
base 2
base 1
acido 2
ione
ammonio
ammoniaca
ione
ossidrile
NH3(aq) + H2O(l) ⇄ NH4+(aq) + OH-(aq)
base 1
acido 2
acido 1
base 2
acido e base coniugata
NH4+ + H2O
H3O+ + NH3
[ H3O+ ]
Ka =
Ka Kb =
Kb =
[NH3] [ OH- ] [NH4+]
[NH4+] [NH3]
OH- + NH4+
[ OH- ]
[NH3]
[NH4+ ]
[ H3O+ ]
NH3 + H2O
[NH4+]
[NH3]
=Kw= [ H3O+ ] [ OH- ]
La forza di acidi e basi
Sono considerati forti gli acidi e le basi che in acqua sono
completamente dissociati, ovvero con equilibrio fortemente
spostato verso destra.
Ad esempio:
HCl(aq) + H2O(l) ⇄ Cl-(aq) + H3O+(aq)
NaOH(aq) + H2O(l) ⇄ Na+(aq) + OH-(aq)
In entrambi gli esempi l’equilibrio è fortemente spostato verso
destra: tutte le molecole di acido cloridrico e idrossido di
sodio risultano in pratica dissociate.
Di conseguenza, una mole di HCl forma 1 mole di H+ e 1 mole di
NaOH forma una mole di OH-.
La forza di acidi e basi
Sono considerati deboli gli acidi e le basi che in acqua sono
parzialmente dissociati, ovvero con equilibrio spostato verso
sinistra.
Ad esempio:
H2S(aq) + H2O(l) ⇄ HS-(aq) + H3O+(aq)
NH3(aq) + H2O(l) ⇄ NH4+(aq) + OH-(aq)
In entrambi gli esempi l’equilibrio è spostato verso sinistra: solo una
parte delle molecole di acido solfidrico e ammoniaca risultano
dissociate.
Di conseguenza, una mole di H2S NON forma 1 mole di H+ e 1 mole di
NH4 NON forma una mole di OH-.
La forza di acidi e basi
Quanto più forte è l’acido o la base, e quindi l’equilibrio è spostato
a destra, tanto più saranno deboli la base coniugata e l’acido
coniugato corrispondente.
Viceversa, quanto più debole è l’acido o la base, e quindi l’equilibrio
è spostato a sinistra, tanto più saranno forti la base coniugata e
l’acido coniugato corrispondente.
HNO3(aq) + H2O(l) ⇄ NO2-(aq) + H3O+(aq)
acido forte
base coniugata debole
HCN(aq) + H2O(l) ⇄ CN-(aq) + H3O+(aq)
acido debole
base coniugata forte
Costanti di ionizzazione acida e basica
HClO3(aq) + H2O(l) ⇄ ClO3-(aq) + H3O+(aq)
3
[ClO ] [ H 3O ]
Ka
[ HClO3 ]
NH3(aq) + H2O(l) ⇄ NH4+(aq) + OH-(aq)
4
[ NH ] [OH ]
Kb
[ NH 3 ]
La forza di un acido
La forza di un acido è determinata dalla
costante di dissociazione acida
Ka =
[H3O+]x [A-]
[HA]
Tanto maggiore sarà il valore della costante e tanto piu’ l’acido sarà
propenso a dissociarsi in soluzione, liberando ioni H+
HA + H2O
H3O+ + A-
Acido e base coniugata
Tanto piu’ un acido è forte, tanto piu’ sarà
debole la sua base coniugata
HCl
Cl-
CH3COOH
CH3COO-
H2CO3
HCO3-
HCN
CNNH3
NH4+
H2O
OH-
OH- = idrossidi
ionici, es: NaOH,
Ca(OH)2, KOH
Autoprotonazione dell’acqua
2 H2O(l) ⇄ H3O+(aq) + OH-(aq)
-
+
Autoprotonazione dell’acqua
2 H2O(l) ⇄ H3O+(aq) + OH-(aq)
Kw = [H3O+] [OH-]
A 25°C si ha Kw = 10-14
Soluzione neutra: [H3O+] = [OH-]
Soluzione acida: [H3O+] > [OH-]
Soluzione basica: [H3O+] < [OH-]
Kw = [H3
Soluzione neutra:
Soluzione acida:
+
O]
[OH ]
[H3O ] [OH ] Kw
[H3O ] Kw ; [OH ] Kw
Soluzione basica: [H3O ] Kw ; [OH ] Kw
a 25°C
[H3O+] > [OH-]
[H3O+]
100
10-1
10-2
10-3
10-4
10-5
Kw
10-6
soluzione acida
[H3O+] > 10-7
[OH-] < 10-7
[H3O+] < [OH-]
10-7
10-8
10-9
10-10
10-11
10-12
10-13
10-14
soluzione basica
soluzione
neutra
[H3O+] = [OH-] = 10-7
[H3O+] < 10-7
[OH-] > 10-7
I logaritmi, questi sconosciuti
log A= B
log 107= 7
log 1= 0
10B= A
log 10-3= -3
1= 100
log AxB= logA + logB
log 1/A= - logA
log 3,2x10-3= log 3,2 - 3
log 1/10-7 =-(log 10-7)= -(-7)=7
Il pH e la sua scala
a 25°C
pH = -log10[H3O+]
pOH = -log10[OH-]
Kw
[H3O+]
100
10-1
10-2
10-3
10-4
10-5
10-6
soluzione acida
pH < 7
pOH > 7
10-7
10-8
10-9
10-10
10-11
10-12
10-13
10-14
soluzione basica
soluzione
neutra
pH = pOH = 7
pH > 7
pOH < 7
H3O+(aq) + OH-(aq) ⇄ 2 H2O(l)
1
1
K
Kw [H3O ] [OH ]
H ° < 0
2 H2O(l) ⇄ H3O+(aq) + OH-(aq)
Kw [H3O ] [OH ]
H ° > 0
2 H2O(l) ⇄ H3O+(aq) + OH-(aq)
T > 25°C
10-13
lnKw
H ° > 0
25°C
10-14
10-15
10-16
1/T
T < 25°C
1/T
Soluzione neutra: [H3O ] [OH ] K w ; pH log 10 K w
A 25°C: pH = 7; a T < 25°C: pH > 7; a T > 25°C: pH < 7
Il pH
[H3O+]
pH = - Log [H3O+]
ACQUA PURA, T=25 °C
[H3O+] = 1 x 10-7
pH = 7
[OH-]
pOH = - Log [OH-]
ACQUA PURA, T=25 °C
[OH-] = 1 x 10-7
pOH = 7
pKw = - Log (Kw)
Kw = [H3O+][OH-] = 10-7·10-7 = 1 x 10-14
-Log (Kw) = -Log {[H3O+][OH-]}
= -Log [H3O+] - Log [OH-]
pKw = pH + pOH = 14
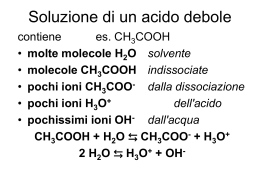
Acido debole (Ka < 1) in concentrazione ca
HA(aq) + H2O(l) ⇄ A-(aq) + H3O+(aq)
(ca – x)
x
x
[A ] [H3O ]
Ka
[HA]
x
Ka
(ca x)
2
Se l’acido è così debole che x << ca, allora:
[H3O ] [A ] Kaca
Base debole (Kb < 1) in concentrazione cb
B(aq) + H2O(l) ⇄ BH+(aq) + OH-(aq)
(cb – x)
x
x
x
Kb
(cb x)
[BH ] [OH ]
Kb
[B]
2
Se la base è così debole che x << cb, allora:
[OH ] [BH ] Kbcb
L’Altalena Coniugata
[
A
]
[
H
O
]
3
HA(aq) + H2O(l) ⇄ A-(aq) + H3O+(aq) K
a
[ HA]
A-(aq) + H2O(l)
⇄ HA(aq)
+ OH-(aq)
[ HA] [OH ]
Kb
[ A ]
[ A ] [ H 3O ] [ HA] [OH ]
K a Kb
[
H
O
]
[
OH
] Kw
3
[ HA]
[A ]
L’Altalena Coniugata
BOH(aq) ⇄ B+(aq) + OH-(aq)
B+(aq) + H2O(l)
⇄ BOH(aq)
+ H+(aq)
[ B ] [OH ]
Kb
[ BOH ]
[ BOH ] [ H ]
Ka
[B ]
[ B ] [OH ] [ BOH ] [ H ]
Kb K a
[
OH
]
[
H
] Kw
[ BOH ]
[B ]
L’Altalena Coniugata
K a Kb Kw
pK a pK b pK w 14
Gli Acidi e le Basi Poliprotiche
Definiamo ACIDO POLIPROTICO, secondo Brønsted . Lowry, un acido in
grado di cedere più di un protone, H+. Definiamo BASE POLIPROTICA,
secondo Brønsted . Lowry, una base in grado di accettare più di un protone.
H2CO3(aq) + H2O(l) ⇄ HCO3-(aq) + H3O+(aq)
HCO3-(aq) + H2O(l) ⇄ CO32-(aq) + H3O+(aq)
[ HCO3 ] [ H 3O ]
K a1
[ H 2CO3 ]
2
[CO3 ] [ H 3O ]
Ka2
[ HCO3 ]
K a K a1 K a 2
H2CO3(aq) + 2H2O(l) ⇄ CO32-(aq) + 2H3O+(aq)
2
2
[ HCO3 ] [ H 3O ] [CO3 ] [ H 3O ] [CO3 ] [ H 3O ]2
Ka
[ H 2CO3 ]
[ H 2CO3 ]
[ HCO3 ]
Si calcolino il pH ed il pOH di una soluzione
acquosa 1.00 x 10-4 M di HClO4
HClO4 è un acido forte con Ka > 1 quindi in H2O si
dissocia completamente:
[H3O+] derivante dall’acido = CHClO4= 1.00 x 10-4 M
pH = -log 1.00 x 10-4 = 4
poiché [H3O+] [OH-] = 1.0 x 10-14 M risulta che:
[OH-] = 1.0 x 10-14/1.0 x 10-4 = 1.0 x 10-10 M
pOH = 10.0
Si noti che pH + pOH = pKw= 14
Nel problema non si è tenuto conto del contributo degli
ioni H3O+ derivanti dalla dissociazione dell’H2O
Si verifica a posteriori che l’approssimazione fatta sia
lecita:
dato che la [OH-] = 10-10 M deriva dalla dissociazione delle
molecole di H2O, la [H3O+] derivante dalla medesima
dissociazione sarà uguale, cioè pari a 10-10 M
Questa concentrazione è trascurabile rispetto alla
concentrazione di [H3O+] derivante dall’acido (10-4 M)
Si calcoli il pH di una soluzione 1.00
di HClO4
x
10-7 M
HClO4 è un acido forte con Ka > 1 quindi in H2O si
dissocia completamente:
CH3O+ derivante dall’acido = CHClO4= 1.00
x
10-7 M
tale concentrazione è paragonabile alla dissociazione
delle molecole di H2O che quindi contribuirà al pH della
soluzione:
[H3O+] = 1.00 x 10-7 + x
dove x è la concentrazione di H3O+ , e quindi anche di
OH-, derivante dalla dissociazione del solvente
quindi:
Kw = (1.00 x 10-7 + x) x = 1.0 x 10-14
x = 0.62 x 10-7 M
la concentrazione totale di [H3O+] = 1.62 x 10-7 M
pH = 6.79
Si noti che il pH è acido come atteso
Solo quando gli ioni H3O+ derivanti da un acido sono
in concentrazione < 10-6 M occorre tenere conto del
contributo della dissociazione dell’acqua al pH
IDROLISI DEI SALI
(reazioni acido-base degli ioni formati per dissociazione
elettrolitica)
NaCl(s) Na+(aq) + Cl-(aq)
in acqua non dà
reazioni acido-base
Cl- è la base coniugata di
HCl, ma quest’ultimo è un
acido così forte che Cl- è
una base con forza
praticamente nulla
Per una coppia acido-base coniugati
si ha:
Ka X Kb = Kw
Per esempio, per la coppia NH4+/NH3:
[NH4 ] [OH ]
Kb
[NH3 ]
[NH3 ] [H3O ]
Ka
[NH4 ]
[ NH 4 ] [OH ] [ NH 3 ] [ H 3O ]
K a Kb
[ NH 3 ]
[ NH 4 ]
[H3O ][OH ] Kw
NaNO2(s) Na+(aq) + NO2-(aq)
NO2- è la base coniugata di
HNO2, e quest’ultimo è un acido
debole quindi…
NO2-(aq) + H2O(l) ⇄ HNO2(aq) + OH-(aq)
[HNO2 ] [OH ]
Kb
[NO2 ]
[OH ] K b cs
Kw
Kb
Ka
IDROLISI BASICA
NH4Cl(s) NH4+(aq) + Cl-(aq)
NH4+ è l’acido coniugato di NH3,
e quest’ultimo è una base debole
quindi…
NH4+(aq) + H2O(l) ⇄ NH3(aq) + H3O+(aq)
[NH3 ] [H3O ]
Ka
[NH4 ]
[ H ] K a cs
Kw
Ka
Kb
IDROLISI ACIDA
Quando in una soluzione sono presenti sia un
acido debole che la sua base coniugata…
Ad esempio, una soluzione di acido Ipocloroso (HClO, concentrazione ca) e Ipoclorito di sodio
(NaClO, concentrazione cb), formerà il seguente equilibrio:
HClO(aq) + H2O(l) ⇄ ClO-(aq) + H3O+(aq)
cb+x
ca -x
x
con ca e cb in quantità paragonabili
[ClO ] [H3O ] (cb x)x
Ka
[HClO]
(ca x)
cb [H3O ]
ca
Ka
; [H3O ] Ka
ca
cb
se x << ca e x << cb
Un soluzione con un acido debole e la sua
base coniugata, con ca e cb in quantità
paragonabili, è un tampone.
Per esempio:
NH3(aq) + H2O(l) ⇄ NH4+(aq) + OH-(aq)
cb
ca
L’aggiunta di una piccola quantità di acido sposta la reazione a destra
L’aggiunta di una piccola quantità di base sposta la reazione a sinistra
Il pH non cambia molto in ambedue i casi
Riepilogo:
Acido debole: [H3O ] Ka ca
Base debole:
Idrolisi acida:
[OH ] K bcb
Kw
cs
Kb
Kw
cs
Ka
[H 3O ]
Idrolisi basica: [OH ]
Riepilogo:
Tampone formato da
un acido debole e la
sua base coniugata:
Tampone formato da
una base debole e il
suo acido coniugato:
ca
[ H 3O ] K a
cb
cb
[OH ] K b
ca
INDICATORI DI pH
HA(aq) + H2O(l) ⇄ A-(aq) + H3O+(aq)
giallo
rosso
[ A ] [ H 3O ]
Ka
[HA ]
[H 3O ] [HA ]
Ka
[A ]
[H 3O ] [HA ] giallo
Ka
[A ] rosso
Quando [H3O+] >> Ka la soluzione appare gialla
Quando [H3O+] << Ka la soluzione appare rossa
Quando [H3O+] Ka la soluzione appare arancione
pKa = - log10 Ka
pH
0
1
2
3
4
5
6
7
8
9
10
11
12
13
14
alcuni indicatori:
fenolftaleina
blu di
bromotimolo
metil arancio
rosso fenolo
pH
0
1
2
3
4
5
6
7
8
9
10
11
12
13
14
Scaricare