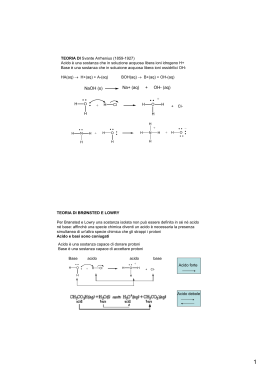
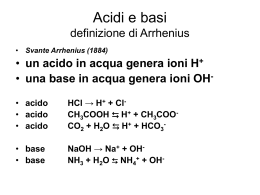
TEORIE DEGLI ACIDI E DELLE BASI Teoria di Arrhenius: Un acido è una sostanza che in soluzione acquosa libera ioni H+ Es. HCl = H+ (aq) + Cl- (aq) H2SO4 = 2 H+ (aq) + SO42- (aq) Una base è una sostanza che in soluzione acquosa libera ioni OHEs. NaOH = Na+ (aq) + OH- (aq) Ca(OH)2 = Ca2+ (aq) + 2 OH- (aq) Teoria di Brönsted e Lowry Un acido è una sostanza che cede protoni trasformandosi nella sua base coniugata. Una base è una sostanza che acquista protoni trasformandosi nel suo acido coniugato. HA b H+ + AAcido Base coniugata dell’acido HA B + H+ b BH+ Base Acido coniugato della base B Punti fondamentali: • Il protone H+ ha una carica positiva molto concentrata nello spazio, e pertanto non si trova libero ed in soluzione acquosa si lega all’acqua H+ + H2O b H3O+ pertanto le reazioni sopra riportate sono, più correttamente: HA + H2O b H3O+ + AAcido Base coniugata dell’acido HA B + H3O+ b BH+ + H2O Base Acido coniugato della base B • L’acqua ha un comportamento particolare e può funzionare sia da acido che da base HA + H2O b H3O+ + AB + H2O b BH+ + OH- Generalizzando, si può dire che una reazione acido base è una processo in cui un acido e una base si trasformano rispettivamente nella base e nell’acido ad essi coniugati, per trasferimento di ioni H+ • Alcuni acidi sono estremamente forti, e la loro dissociazione è completa. Analogamente vale per le basi. HCl + H2O → H3O+ + ClC2H5O- + H2O → C2H5OH + OH• Per altri, la reazione non è completamente spostata né a sinistra, né a destra. Si instaura un equilibrio: CH3COOH + H2O b CH3COO- + H3O+ NH3 + H2O b NH4+ + OHPer acidi o basi come questi, si possono scrivere una costante di dissociazione acida o basica. Costante di dissociazione acida: H 3O + A − Ka = [ HA ] Costante di dissociazione basica: BH + OH − Kb = [ B] pKa = -log10 Ka pKb = -log10 Kb Al crescere della Ka, il valore di pKa diminuisce (stessa cosa per Kb). Tanto maggiore è il valore di questa costante, ovvero tanto minore è il valore della pK, tanto maggiore è la quantità di acido o base trasformate nelle rispettive basi o acidi coniugati. Queste costanti variano con la temperatura (costanti a temperatura costante) Ka . Kb = [H3O+][OH-] = Kw = 1 · 10-14 PRODOTTO IONICO DELL’ACQUA (costante a temperatura costante) • In una reazione acido base, la reazione è spostata nel senso in cui si formano l’acido e la base più deboli. HCl + NO2- b HNO2 + Cl- Scala di pH pH = -log10[H3O+] pOH = -log10[OH-] Kw = [H3O+][OH-] allora pKw = -logKw = -log[H3O+] -log[OH-] = 14 pKw = pH + pOH = 14 In una soluzione acida pH < 7 In una soluzione neutra pH = 7 In una soluzione neutra pH > 7 pOH = 14 – pH [H3O+] > 10-7 M [H3O+] = 10-7 M [H3O+] < 10-7 M • MAGGIORE E’ LA CONCENTRAZIONE DI [H3O+], MINORE E’ IL pH Soluzioni tampone I sistemi tampone sono soluzioni che hanno la caratteristica di non variare in modo significativo il proprio pH per aggiunta di piccole quantità di acido o di base. Le soluzioni tampone sono generalmente composte da: • Un acido debole e dalla sua base coniugata (es. CH3COOH / CH3COO-) • Una base debole a dal suo acido coniugato (es. NH3 / NH4+) La base e l’acido coniugati sono ottenuti aggiungendo alla soluzione di acido o di base un sale quale CH3COONa nel primo caso o NH4Cl nel secondo. L’equilibrio presente in soluzione sarà: CH3COOH + H2O = CH3COO- + H3O+ Equilibrio regolato dalla costante di dissociazione acida: H 3O + A − Ka = [ HA ] Da cui di ottiene, riarrangiando: H 3O + = K eq [ HA ] A - ed applicando l’operatore (–log10): − log10 H 3O + = pH = − log10 K a − log10 [ HA ] A - siccome le specie HA ed A- derivano rispettivamente dall’acido e dal sale utilizzati per fare la soluzione tampone, si ha [HA] = conc. acido = Ca e [A-] = conc. sale = Cs si ottiene pH = pK a − log10 Ca C = pK a + log10 s Cs Ca Per una sistema che coinvolge una base debole ed un suo acido coniugato, ad esempio: NH3 + H2O = NH4+ + OHSi dimostra che vale la relazione (analoga alla precedente): pH = 14 − pK b − log10 dove con Cs = [NH4+] e Cb = [NH3]. Cs Cb Ad un’aggiunta di acido, ovvero di ioni H3O+, entrerà in gioco l’equilibrio di riprotonazione della base coniugata, neutralizzando l’acido aggiunto: CH3COO- + H3O+ = CH3COOH + H2O Ad un’aggiunta di base, ovvero di ioni OH-, entrerà in gioco l’equilibrio di dissociazione dell’acido, neutralizzando la base aggiunta: CH3COOH + OH- = CH3COO- + H2O Un sistema tampone acido debole / sale (o base debole / sale) è nella situazione ottimale (ovvero di massima efficienza) quando le quantità di acido e sale o base e sale sono uguali, ovvero quando pH = pKa (pH = pKb per le basi). Il sistema CH3COOH / CH3COO- è un buon tampone per pH vicini a 4.8, mentre il sistema NH3 / NH4+ è un buon tampone per pH vicini a 9.2. COMPOSTI DI COORDINAZIONE Sono composti che si formano per reazione tra una specie con vacanze elettroniche (in genere ioni metallici) e specie con doppietti elettronici disponibili per legami dativi. Es. Cu2+ + 4 NH3 b [Cu(NH3)4]2+ Il legame che si instaura è un legame dativo e nel caso specifico si chiama legame coordinativo (Figura 1). Le molecole legate alla specie metallica (nel caso precedente, NH3) sono chiamati leganti. La specie metallica è un acido di Lewis, la specie legante è una base di Lewis. Le unità complesse si indicano racchiudendo la specie metallica e i leganti dentro a parentesi quadre come ad esempio [Cu(NH3)4]2+. • I complessi possono essere carichi negativamente ([Fe(CN)6]3-), positivamente ([Cu(NH3)4]2+) o neutri ([Ni(CO)4]) • La particolarità dei sali contenenti specie complesse (es. K3[Fe(CN)6]) è che la reattività di questo sale non è combinazione di quelle di K+, Fe3+ e CN-, ma piuttosto di quelle di K+ e di [Fe(CN)6]3-. • I leganti possono essere monodentati (ossia in grado di scambiare 1 legame col metallo, es. NH3), bidentati (H2N-CH2-CH2-NH3, etilendiammina, en) e così via fino ad esadentati (EDTA) e anche oltre… • Il numero complessivo di legami scambiati dal metallo con i leganti è detto numero di coordinazione (Figura 2): Ag+ in [Ag(NH3)2]+ ha numero di coordinazione 2 Zn2+ in [Zn(NH3)4]2+ ha numero di coordinazione 4 Co3+ in [Co(NH3)6]3+ ha numero di coordinazione 6 Ca2+ in [Ca(EDTA)]2- ha numero di coordinazione 6 ecc. Sono esempi di composti di coordinazione di importanza biologica o applicativa (Figure 3 e 4): o Il gruppo eme dell’emoglobina o La clorofilla a o Il complesso [Ca(EDTA)]2- Nomenclatura dei composti di coordinazione 1. Se sono presenti una unità cationica e una anionica, il nome dell’anione precede quello del catione. 2. Se il legante ha desinenza –ito o –ato, il suo nome resta invariato 3. Se il legante ha desinenza –uro prende desinenza –o (cloruro → cloro) 4. Se è H2O, OH- o NH3 diviene come segue: OH- = idrosso NH3 = ammina H2O = aqua 5. Per i leganti monodentati, se presenti in numero maggiore di uno, si usa il prefisso di-, tri-, tetra-, penta-, esa- ecc. 6. Se lo ione complesso è un anione, al nome del metallo si aggiunge la desinenza –ato. 7. Il numero di ossidazione va indicato dentro parentesi, dopo il metallo, in numeri romani. Cloruro di esaamminanichel(II) a. [Ni(NH3)6]Cl2 Esacianoferrato(III) di potassio b. K3[Fe(CN)6] Tetraamminadiclorocobalto(II) c. [Co(NH3)4Cl2] Tetraidrossoalluminato(III) di sodio d. Na[Al(OH)4] Tetraclorocuprato(II) di potassio e. K2[CuCl4] Cloruro di esaamminacobalto(III) f. [Co(NH3)6]Cl3 A volte si utilizzano solo gli ioni complessi, che hanno nomi analoghi: [Al(OH)4][Cu(NH3)2]+ [CuCl4]2- Ione tetraidrossoalluminato(III) Ione diamminorame(II) Ione tetraclorocuprato(II) (N.B. notare la differenza del nome degli ioni contenenti Cu2+ quando sono cationi e quando sono anioni). Esempi di leganti polidentati: H2N H2N Etilendiammina (en), bidentato. NH2 Dietilentriammina (dien), tridentato. N H H2N O O O N O O O O Etilendiamminatetraacetato (EDTA), esadentato. N O Figura 1. Schema della reazione Cu2+ + 4NH3 = [Cu(NH3)4]2+ Figura 3. Struttura di [Ca(EDTA)]2- Figura 2: Strutture dei complessi [Ag(NH3)2]+, [Zn(NH3)4]2+ e [Co(NH3)6]2+ Figura 4. Strutture del gruppo eme (contenente Fe2+) e della clorofilla a (contenente Mg2+). EQUILIBRI DI SOLUBILITA’ Solubilità (S) di un sale o di un composto = concentrazione della soluzione satura. AgCl (s) b Ag+ (aq) + Cl- (aq) In una soluzione satura in equilibrio col suo corpo di fondo la velocità di dissoluzione del solido in ioni è pari alla velocità di precipitazione degli ioni sotto forma di sale solido. La costante di equilibrio di questo processo è: K eq = [Ag + ][Cl− ] [AgCl(s) ] e siccome [AgCl(s)] nella fase solida è costante, si ha: Keq · [AgCl(s)] = Ks = [Ag+][Cl-] Ks è detto prodotto di solubilità. In un dato solvente, esso dipende solo dalla temperatura. Nel caso dell’equilibrio: Ca3(PO4)2 (s) b 3 Ca2+ (aq) + 2 PO43- (aq) si avrà: Ks = [Ca2+]3·[PO42-]2 Relazione tra solubilità (S) e Ks Ca3(PO4)2 (s) b 3 Ca2+ (aq) + 2 PO43- (aq) 1 mole di Ca3(PO4)2 dissociata dà 3 moli di Ca2+ e 2 di PO43-. Percui [Ca2+] = 3S [PO43-] = 2S dove S è la solubilità (in moli/litro) del sale. Pertanto: Ks = [Ca2+]3·[PO42-]2 = (3S)3·(2S)2 = 33·22·S(3+2) = 108·S5 In generale per un sale AnBm, si ha Ks = nn·mm·S(n+m) S=5 o anche S = (n +m) Ks 108 Ks (n ⋅ m m ) n Punti fondamentali: • La solubilità di un sale aumenta all’aumentare del Ks, mentre diminuisce al diminuire di questo. Pertanto l’effetto della temperatura sul Ks si riflette in un effetto della temperatura sulla solubilità. • Sali che possiedono un Ks molto piccolo (e quindi basse solubilità) sono detti poco solubili o insolubili • La solubilità dei sali è influenzata da diversi fattori fra i quali: o o o o Temperatura Effetto dello ione comune Solvente Formazione di complessi Fattori che influenzano la solubilità dei sali: • Temperatura Per la maggior parte dei sali, un aumento della temperatura porta ad un aumento del Ks e quindi ad un aumento della solubilità • Ione comune Aggiungendo un sale solubile ad una soluzione di un sale poco solubile che abbia uno degli ioni in comune col primo, la solubilità del secondo si riduce. Es. Aggiungendo NaCl (solubile) a una soluzione di AgCl. Siccome Ks = [Ag+][Cl-] deve essere costante, un aumento di ioni Cl- porta ad una diminuzione di ioni [Ag+], e siccome S = [Ag+] la solubilità diminuisce. • Cambio di solvente Immaginiamo un sale (es. Na2CO3) molto solubile in acqua ma pochissimo in alcol etilico. Se aggiungiamo alcol etilico ad una soluzione acquosa di Na2CO3 otterremo la progressiva precipitazione del carbonato di sodio solido. • Formazione di complessi L’aggiunta ad una soluzione di un sale di composti in grado di formare complessi con il catione, ad esempio, portano ad un aumento di solubilità. Es. Aggiungendo NH3 ad una soluzione di AgCl. L’aggiunta di NH3 in grado di formare [Ag(NH3)2]+ porta ad una riduzione di [Ag+] e siccome Ks = [Ag+][Cl-] deve essere costante, gli ioni Ag+ via via mancanti vengono ripristinati da altro solido (corpo di fondo) che passa in soluzione.
Scaricare