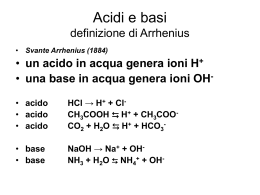
Le definizioni di acido e di base Un percorso storico Teoria degli acidi e delle basi Cos’è un acido? Cos’è una base? Una sostanza corrosiva, chimicamente molto attiva, che colora di rosso la cartina di indicatore universale, ha un sapore aspro Una sostanza corrosiva, chimicamente molto attiva, che colora di blu la cartina di indicatore universale, ha un sapore amaro Possono essere considerati in chimica gli opposti Reagiscono neutralizzandosi 2 Definizioni secondo Arrhenius È un acido Una sostanza che, in acqua, libera ioni H+ È chiamato protone, idronio, idrossonio HCl, H2SO4, H3PO4, H2S, HClO4, HNO3, HNO2 , CH3COOH ecc. HCl H+ + Cl H2SO4 2H+ + SO42 H3PO4 3H+ + PO43È una base Una sostanza che, in acqua, libera ioni OH È chiamato ossidrile NaOH, KOH, Ca(OH)2, Mg(OH)2, Al(OH)3, ecc. NaOH Na+ + OH Ca(OH)2 Ca2+ + 2OH Al(OH)3 Al3+ + 3OH- 3 Perché gli acidi e le basi… …si dissociano in modo differente? Cl – O – H 3,0 0,5 3,5 1,4 2,1 Na – O – H 0,9 2,6 3,5 1,4 2,1 4 Limiti della teoria di Arrhenius Gli equilibri acido-base possono avvenire anche in ambienti non acquosi Ci sono sostanze acide e basiche che non si comportano così Vediamo l’esempio dell’ammoniaca È una base ma non possiede un gruppo OH da liberare NH3 + H2O NH4+ + OH5 Brönsted - Lowry È un acido Una sostanza che cede ioni H+ È una base Una sostanza che accetta ioni H+ NH3 + H2O NH4+ + OH Per Bronsted e Lowry esistono equilibri acido-base dove le specie partecipanti possono essere denominate coppie acidobase coniugate Sono due specie chimiche che differiscono solo per un protone 6 Coppie coniugate acido-base NH3 + H2O NH4+ + OHbase 1 acido 2 acido 1 base 2 differiscono per un H+ HCl + H2O H3O+ + Clacido 2 base 1 acido 1 base 2 differiscono per un H+ 7 Forza delle specie coniugate Se un acido o una base è forte la sua specie coniugata sarà una base o un acido molto debole e viceversa NH3 + H2O(l) NH4+ + OH- NH OH Kb 4 Ka NH 3 NH 3 H NH 4 NH4+ NH3 + H+ K a Kb NH H NH OH K NH NH 3 4 4 3 w 1,0 10 14 8 Forza relativa degli acidi HCl + CH3COOH CH3COOH2 + + Clacido 1 base 2 acido 2 base 1 differiscono per un H+ 9 Costante di dissociazione acida H Cl HCl H+ + Cl- Ka HCl + H2O H3O+ + Cl 3 HCl H 2O H O Cl H O K Ke 3 2 HCl H O Cl Ke HCl a 10 Forza degli acidi e delle basi La Ka e la Kb sono direttamente proporzionali alla forza dell’acido o della base rispettivamente 11 Neutralizzazione Le reazioni tra un acido ed una base si chiamano “neutralizzazioni” Ca(NO3)2 nitrato di calcio 2NaOH + H2CO3 2Na+ + CO32- + 2H2O NaCl Ca(OH)2 + 2HNO3 Ca2+ + 2NO3- + 2H2O Perché si ottengono dei prodotti che non manifestano la stessa elevata reattività dei reagenti (corrosività) Acido + base sale + acqua HCl + NaOH Na+ + Cl- + H2O H+ + OH- H2O Na2CO3 carbonato di sodio NaOH + H2CO3 Na+ + HCO3- + H2O NaHCO3 bicarbonato di sodio 12 Lewis La teoria di Lewis si basa sullo scambio di coppie di elettroni Acido: È una specie chimica che acquisisce un doppietto elettronico Base: È una specie chimica che cede un doppietto elettronico 13 Considerazioni H H N: H F B F F La definizione di Lewis permette di: Definire reazioni acido-base anche le reazioni di formazioni di complessi (formazione di legami dativi) La specie che dona elettroni si comporta come base La specie che accetta elettroni si comporta come acido In questo tipo di reazioni non deve avvenire per forza lo scambio di protoni 14 Interpretiamo i “vecchi” acidi e basi NH3 + H2O NH4+ + OHH H N: H+ NaOH H : : : H O- : H H+ H O: 15
Scaricare