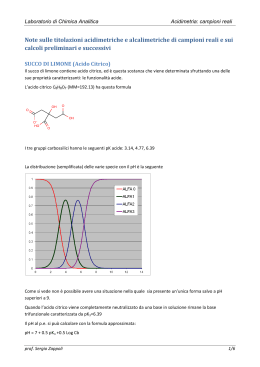
25 mL NaOH 0,250 M • titoliamo con HCl 0,340 M • all'inizio: pOH = - log 0,250 = 0,60 pH=13,40 • nOH- = V [OH-] = 0,025 L 250 mmol/L = 6,25 mmol • dopo aggiunta di 5,00 mL HCl: • nH+ = 0,005 L 340 mmol/L = 1,70 mmol [OH ] nOH V (6,25 1,70)mmol 0,152M 30mL • pOH = -log 0,152 = 0,82 pH=13,18 segue 25 mL NaOH 0,250 M • l'equivalenza si ha quando si aggiunge un VHCl che contiene 6,25 mmol di HCl VHCl nHCl 6,25mmol Veq 18,38mL cHCl 0,340mmol / mL • all'equivalenza • nHCl = nNaOH pOH = pH = 7,00 VHClcHCl = VNaOHcNaOH segue 25 mL NaOH 0,250 M • aggiungiamo 1 mL HCl oltre l'equivalenza • VHCl = 19,38 mL • nHCl = 0,01938 L 340 mmol/L = 6,59 mmol [ H 3O] nH 3O V (6,59 6,25)mmol 3 7,66 10 M (25,00 19,38)mL • pH = - log 7,6610-3 = 2,12 Titolazione di acido debole con base forte • • • • Titoliamo l'acido formico HCOOH con idrossido di sodio NaOH si forma formiato di sodio HCOONa (HCOO- Na+) all'equivalenza si ha HCOONa sale di acido debole: • pH > 7 • all'inizio si ha HCOOH acido debole • durante la titolazione si ha HCOOH e HCOONa soluzione tampone • dopo la titolazione il pH è controllato dalla base in eccesso Titolazione acido forte/base forte Titolazione di 100 mL di HCl 0.100 M con NaOH 0.100 M. Il punto finale (equivalente) viene evidenziato con molti indicatori. Fenolftaleina Blu di bromotimolo pH Punto di equivalenza Verde di bromocresolo Intervallo di viraggio Volume di NaOH 0.100 M (mL) Titolazione acido debole / base forte Acido debole Curva di titolazione ( azzurra ) di un acido debole ( 100 mL di CH3COOH 0.100 M ) con NaOH 0.100 M in confronto con quella relativa ad un acido forte ( rossa ) di eguale concentrazione. Fenolftaleina Punto di equivalenza Blu di Bromotimolo zona tampone Punto di metà Equivalenza pH = pKa Acido forte Volume di NaOH 0.100 M (mL)
Scaricare