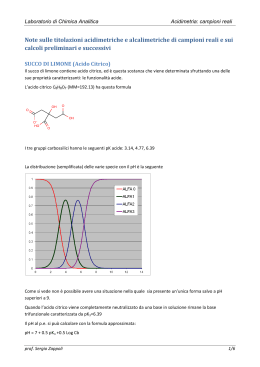
Titolazioni • • • • • Indicatori acido-base Titolazioni acido-base Curve di titolazione Equilibri eterogenei Prodotto di solubilità Titolazione • E’ una tecnica analitica per identificare il punto di equivalenza • Per quelle acido-base il punto in cui ad una base da titolare è stato aggiunto una quantità equivalente di acido (o viceversa) • Il pH del punto di equivalenza varia con la forza dei reagenti • È istruttivo valutare come varia il pH con l’aggiunta del titolante: curve di pH. Acido forte e base forte • Es. NaOH con HCl • Al punto di equivalenza (es. 1 mol NaOH e 1 mol HCl) si hanno Na+ e Cl• Questi ioni non hanno comportamento acido, non influenzano l’acqua che avrà pH 7 • Prima e dopo la titolazione si ha soluzione di base forte ed acido forte, quindi il cambiamento di pH è repentino Titolazione acido debole con una base forte • Es. acido formico con NaOH • Al punto di eqivalenza si ha Na+ e HCOO- che è una base • Quindi la soluzione è basica • Il pH può essere calcolato con l’equazione dell’idrolisi dei Sali: [OH ] Kw / Ka.Cs Curva di pH • La curva di pH è asimmetrica: • Con l’aggiunta di NaOH si forma del sale (HCOO-) ed è presente acido (HCOOH), il pH può essere calcolato con l’equazione di Henderson-Hasselbach. • Al punto di equivalenza si ha HCOONa • Dopo il punto di equivalenza prevale l’effetto di NaOH, che cede OH- Titolazione base debole con acido forte • Es. NH4OH con HCl • Il punto di equivalenza è a pH acido Indicatori • Il punto di equivalenza può essere riconosciuto dal brusco cambiamento di pH che può essere visualizzato con un indicatore • Indicatore: una molecola che cambia di colore al variare del pH • Diversi indicatori hanno pH di viraggio diversi, vanno scelti in base al pH del punto di equivalenza Ac acetico In questa semplice titolazione un cilindro contiene 100 ml do NaOH. L’altro cilindro contiene 40 mL di acido acetico. Questo è versato nel beaker e si aggiunge una goccia di indicatore. La soluzione è agitata e la soluzione di NaOH è aggiunta lentamente. L’indicatore comincia a diventare. Quando il rosa è stabile la titolazione è finita. 42 ml di NaOH sono state usate per titolare 40 ml di acido acetico. Meccanismo della titolazione • L’indicatore, fenftaleina, rimane incolore a pH acido quando è protonato, ed è colorato a pH basico, quando è un anione Alcuni indicatori Tamponi • A metà della titolazione, quando la soluzione contiene quantità quasi uguali di acido debole (o base) e di sale il pH cambia poco. • Questa soluzione si oppone ai cambiamenti di pH indotti da H+ o OH- Capacità di un tampone • Quantità di acido o base che può essere aggiunta senza che il tampone perda la sua capacità di opporsi a modificazioni del pH. • L’effetto tamponante migliore è a pH = pKa, ed in intervallo +/- una unità di pH. Equilibri eterogenei in Soluzione • Ki • Prodotto solubilità • Coefficiente di ripartizione Equilibri di solubilità • In una soluzione satura esiste un equilibrio tra parte disciolta e insolubile • Quanto può essere definito con costanti opportune Effetto dello ione in comune • Es. AgCl e NaCl hanno lo ione Cl- in comune • AgCl è poco solubile con una • Kps =[Ag+].[Cl-] • Se aggiungiamo NaCl, la [Ag+] cala • [Ag+] = Kps / [Cl-] Effetto pH • Es. Sali MA di un acido debole AH • Aggungendo acidi si favorisce la forma indissociata HA che quindi sottrae A- la prodotto di solubilità • Questi Sali sono molto più solubili in ambiente acido che in acqua • Esempi: carbonato, solfuro, cromato Formazione di complessi • L’ ammoniaca scioglie un precipitato di AgCl perché forma un complesso • Il complesso rimuove gli ioni Ag+ e quindi aumenta la solubilità di AgCl • La formazione del complesso è un equilibrio che può essere definito da una costante; Kf Costanti di formazione
Scaricare