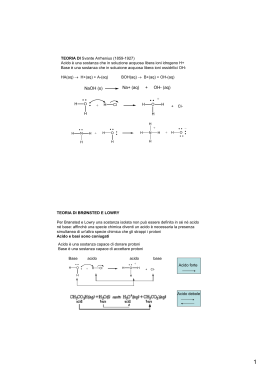
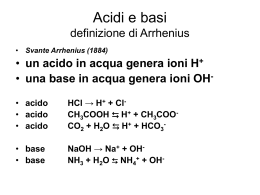
Anteprima Estratta dall' Appunto di Chimica analitica Università : Università degli studi di Milano Facoltà : Farmacia Indice di questo documento L' Appunto Le Domande d'esame ABCtribe.com e' un sito di knowledge sharing per facilitare lo scambio di materiali ed informazioni per lo studio e la formazione.Centinaia di migliaia di studenti usano ABCtribe quotidianamente per scambiare materiali, consigli e opportunità Più gli utenti ne diffondono l'utilizzo maggiore e' il vantaggio che ne si può trarre : 1. Migliora i tuoi voti ed il tempo di studio gestendo tutti i materiali e le risorse condivise 2. Costruisci un network che ti aiuti nei tuoi studi e nella tua professione 3. Ottimizza con il tuo libretto elettronico il percorso di studi facendo in anticipo le scelte migliori per ogni esame 4. Possibilità di guadagno vendendo appunti, tesine, lezioni private, tesi, svolgendo lavori stagionali o part time. www.ABCtribe.com ABCtribe.com - [Pagina 1] L' Appunto A partire dalla pagina successiva potete trovare l' Anteprima Estratta dall' Appunto. Se desideri l'appunto completo clicca questo link. Il numero di pagina tra le parentesi tonde si riferisce a tutto il documento contenente l'appunto. Sull'appunto stesso in alcuni casi potrete trovare una altra numerazione delle pagine che si riferisce al solo appunto. Grafico dei voti medi per questo esame: Grafico dei giorni medi per la preparazione di questo esame: Grafico Copyright © ABCtribe.com. Vietata la riproduzione. Grafico Copyright © ABCtribe.com. Vietata la riproduzione. Clicca qui per i grafici aggionati su Chimica analitica >> ABCtribe.com - [Pagina 2] Acidi e Basi Arrhenius Secondo Arrhenius, si chiamano acidi le sostanze contenenti idrogeno dissociabile, che, in soluzione acquosa, formano soluzioni che presentano una concentrazione di ioni idrogeno (più esattamente di ioni ossonio) maggiore di quella nell’acqua pura, alla stessa temperatura. Secondo Arrhenius, si chiamano basi le sostanze contenenti il gruppo OH dissociabile, che, in soluzione acquosa, formano soluzioni che presentano una concentrazione di ioni ossidrile maggiore di quella nell’acqua pura. om I limiti della teoria di Arrhenius sono i seguenti: e.c 1) i concetti di acido e base sono confinati ad un particolare solvente: l’acqua, rib 2) la teoria non è in grado di spiegare il comportamento basico di alcune Ct sostanze come l’ammoniaca, AB 3) la teoria non è in grado di spiegare il comportamento acido di ioni quali NH4+, Al3+ o basico quali NO2-, CH3COO- ; per fare questo Arrhenius introduce il concetto di idrolisi. Arrhenius introduce il grado di dissociazione degli acidi, in soluzione acquosa, che è preso come misura della cosiddetta forza degli acidi. Il punto chiave della teoria di Arrhenius, che trovò poi applicazione nelle teorie successive, è il concetto di acido e base forte e di acido e base debole. La forza è legata al grado di dissociazione che ha l’acido o la base in soluzione. ABCtribe.com - [Pagina 3] Brønsted-Lowry Nel 1923 il chimico danese Johannes Brønsted propose la definizione in base alla quale un acido è un donatore di protoni, e una base è un accettore di protoni. Le stesse definizioni furono proposte, indipendentemente, dall'inglese Thomas Lowry. Riferendoci agli acidi e alle basi, nel corso di questo capitolo, intenderemo sempre basarci sulla definizione di Brønsted-Lowry. Secondo la teoria di Brønsted-Lowry affinché un acido possa dissociarsi è necessario che ci sia una sostanza in grado di accettare un protone. Quando, per esempio, una molecola di acido cloridrico si dissocia in om acqua, cede un protone ad una molecola di solvente: HCl(aq) + H2O(l) > H3O+(aq) + Cl-(aq) e.c Poiché HCl cede un protone, si tratta di un acido in base alla definizione rib Brønsted. Come è stato detto precedentemente, HCl è un acido forte, nel Ct senso che tutte le molecole di HCl cedono il proprio protone alla base acqua. La definizione di Brønsted comprende pure l’eventualità che a AB comportarsi da acido sia una specie ionica. Ad esempio, lo ione idrogeno carbonato (più familiarmente inteso come «bicarbonato»), HCO3- può agire da donatori di protoni: HCO3-(aq) + H2O(l) H3O+(aq) + CO32-(aq) Nella realtà sono pochissimi gli ioni HCO3- che cedono il protone, quindi il bicarbonato è un esempio di acido debole e la reazione di dissociazione è una reazione di equilibrio. Le basi di Broensted comprendono tutte le sostanze che comunemente consideriamo basi, quali NaOH, Ca(OH)2 e Fe(OH)3, oltre a quelle che possono accettare protoni, quali gli ossidi dei metalli, come CaO, Na2O . Quando questi si sciolgono in acqua la soluzione contiene ioni OH-. La spiegazione di questo fatto è la seguente: la carica negativa dello ione O2strappa un protone ad una molecola H2O. Lo ione ossido instaura un ABCtribe.com - [Pagina 4] legame covalente con il protone mettendo in comune entrambi gli elettroni, e diventando uno ione ossidrile: O2-(aq) + H2O(l) > 2OH-(aq) Riassumendo l’intero processo è rappresentato dalla seguente trasformazione chimica: CaO(s) + H2O(l) > Ca2+(aq) + 2OH-(aq) Molti composti molecolari contenenti azoto sono pure basi in virtù della coppia solitaria di elettroni presente sull'atomo di azoto, capace di legare un protone. Ad esempio, quando l'ammoniaca, NH3, si scioglie nell'acqua, una frazione delle sue molecole accetta protoni secondo la om reazione: e.c NH3(aq) + H2O(l) NH4+(aq) + OH-(aq) rib In tale reazione la molecola NH3 si comporta allo stesso modo dello ione ossido O2-, ma mentre in acqua gli ioni O2- si trasformano tutti in Ct ossidrile, la coppia solitaria dell'atomo di azoto in NH3 possiede nei AB confronti dei protoni dell'acqua un potere attrattivo assai minore di quello della carica negativa del gruppo O2-, e a trasformarsi in ioni NH4+ è soltanto una piccolissima frazione delle molecole NH3. L’ammoniaca è un esempio di base debole e la reazione è di equilibrio. ABCtribe.com - [Pagina 5] Acidi e basi coniugate Quando CH3COOH si scioglie nell'acqua, forma ioni idronio e ioni acetato secondo la reazione di dissociazione sotto riportata, che rappresenta uno dei processi che avvengono in soluzione: CH3COOH(aq) + H2O(l) H3O+(aq) + CH3COO-(aq) Di conseguenza CH3COOH è un acido. Lo ione CH3COO-, però, è in grado di accettare un protone da una molecola che chiamiamo donatore, trasformandosi di nuovo in acido acetico. H3O+(aq) + CH3COO-(aq) CH3COOH(aq) + H2O(l) om Di conseguenza l'acetato è una base. Poiché lo ione acetato deriva dall'acido acetico in virtù della cessione di un protone, si chiama base rib e.c coniugata dell'acido acetico. Ct Secondo tale definizione Cl- è la base coniugata di HCl , O2- è la base AB coniugata di OH-, CH3COOH è l'acido coniugato della base CH3COO- . Analogamente HCl sarà l'acido coniugato di Cl- e OH- l'acido coniugato di O2-. In generale un acido debole dà luogo ad una reazione di equilibrio: HA(aq) + H2O(l) H3O+(aq) + A-(aq) Come vedremo in seguito è corretto pensare che l’anione di un acido debole reagisca con il protone per formare di nuovo l’acido quando l’anione dell’acido debole deriva dalla dissoluzione e dissociazione di un sale: HO CH3COONa(s) CH3COO-(aq) + Na+(aq) 2 CH3COO-(aq) + H2O(l) CH3COOH(aq) + OH-(aq) Quanto sopra esposto, con le opportune modifiche, si deve estendere anche alle basi deboli. ABCtribe.com - [Pagina 6] ESEMPIO 584 Scrivere la formula chimica: a) degli acidi coniugati di CH3NH2 e di CN-; b) delle basi coniugate di HSO4- e di HI. CH3NH2(aq) + H3O+(aq) CH3NH3+(aq) + H2O(l) CN-(aq) + H3O+(aq) HCN(aq) + H2O(l) HSO4-(aq) + H2O(l) SO42-(aq) + H3O+(aq) om HI(aq) + H2O(l) > I-(aq) + H3O+(aq) ESEMPIO 585 e.c Scrivere la formula chimica: rib a) degli acidi coniugati di NH3 e di CO32-; Ct b) delle basi coniugate di NH3 e di HNO3. AB NH3(aq) + H3O+(aq) NH4+(aq) + H2O(l) CO32-(aq) + H3O+(aq) HCO3-(aq) + H2O(l) NH3 + OH- NH2- + H2O HNO3(aq) + H2O(l) > H3O+(aq) + NO3-(aq) ESEMPIO 586 Identificare: (a) l'acido e la base di Broensted nei reagenti e nei prodotti della seguente reazione: HNO3(aq) + HPO42-(aq) NO3-(aq) + H2PO4-(aq) In base alle definizione sopra riportate nei reagenti l’acido è HNO3 e la base è HPO42- , mentre nei prodotti la base è NO3- e l’acido è H2PO4-. ABCtribe.com - [Pagina 7] Scambio di protoni tra le molecole d'acqua Abbiamo visto che la molecola dell'acqua accetta un protone da un acido formando lo ione H3O+. In questo caso l'acqua è una base. Però una molecola di acqua è in grado di cedere un protone a una base trasformandosi in ione ossidrile OH-. In questo caso l’acqua è un acido. L'acqua ha natura anfiprotica, cioè può comportarsi come una sostanza che accetta protoni (base) o che cede protoni (acido). Nel caso dell’acqua pura però i protoni possono trasferirsi dall'una all'altra molecola di acqua secondo la reazione di equilibrio: om 2 H2O(l) H3O+(aq) + OH-(aq) Il trasferimento dei protoni è velocissimo, e l'equilibrio è sempre e.c presente così nell'acqua pura come in tutte le soluzioni acquose. Questo rib tipo di reazione, nella quale una molecola trasferisce un protone ad Ct un’altra molecola della stessa specie, prende il nome di autoprotolisi. AB La prova sperimentale dell’esistenza di questo equilibrio è che l’acqua purissima conduce, seppure poco, la corrente elettrica.1 La costante di equilibrio della reazione di autoprotolisi dell'acqua è: H O xOH KC = 3 H 2 O2 Nell’acqua pura e nelle soluzioni diluite, il solvente acqua ha una concentrazione pressoché costante, il cui valore può essere inglobato nella costante KC che diventa così un’altra costante Kw chiamata costante del prodotto ionico: Kw = [H3O+]x[OH-] ABCtribe.com - [Pagina 8] Questo documento e' un frammento dell'intero appunto utile come anteprima. Se desideri l'appunto completo clicca questo link. ABCtribe.com - [Pagina 9] Preparati con le domande di ABCtribe su Chimica analitica. 1. Calcolare quanti ml di una soluzione 1 M di HCl è necessario aggiungere a 100 ml di una so Risposta: HCl in difetto + NH3 formano il tampone ammoniacale MH3 / NH4+ (o NH4Cl se preferisci) t.c. [OH-] = Kb * [NH3]/[NH4+] OH- lo ricavo da pOH = 14 - pH = 14 - 9.5 = 4.5 ===> [OH-] = 10^-4.5 ==> [NH3]/[NH4+] = [OH-]/Kb = 10 [Clicca qui >> per continuare a leggere]. 2. Calcolare la temperatura di congelamento di una soluzione contenente 10,0 Risposta: in primi calcoliamo le moli del sale A2B: 10.0 g / 100 g/mol = 0.1 mol il sale si dissocia completamente: A2B [Clicca qui >> per continuare a leggere]. * Carica Appunti,Domande,Suggerimenti su : Chimica analitica e guadagna punti >> * Lezioni Private per Chimica analitica >> Avvertenze: La maggior parte del materiale di ABCtribe.com è offerto/prodotto direttamente dagli studenti (appunti, riassunti, dispense, esercitazioni, domande ecc.) ed è quindi da intendersi ad integrazione dei tradizionali metodi di studio e non vuole sostituire o prevaricare le indicazioni istituzionali fornite dai docenti. Il presente file può essere utilizzato in base alle tue necessità ma non deve essere modificato in alcuna sua parte, conservando in particolare tutti i riferimenti all’autore ed a ABCtribe.com; non potrà essere in alcun modo pubblicato tramite alcun mezzo, senza diverso accordo ABCtribe.com - [Pagina 10] scritto con l’autore ed i responsabili del progetto ABCtribe.com. Per eventuali informazioni, dubbi o controversie contattate la redazione all’indirizzo [email protected]. ABCtribe.com - [Pagina 11]
Scarica