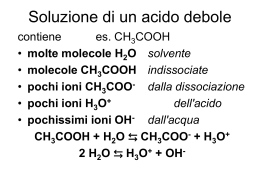
Equilibri ionici in soluzione acquosa L’acqua anche se purissima rivela una conducibilità elettrica molto piccola che indica la presenza di ioni. Infatti una ridottissima frazione di molecole è dissociata in ioni: H2O H2O H+(aq) + OH-(aq) Questa equazione rappresenta la ionizzazione spontanea dell’acqua che è detta autoionizzazione o autoprotolisi dell’acqua. L’equilibrio è molto spostato a sinistra perché la dissociazione ionica riguarda un numero molto ridotto di molecole. La costante di equilibrio della reazione di autoprotolisi dell’acqua è: [H ]⋅ [OH ] = 1,8 ⋅10 K= + [H 2O] − −16 dove [X] indica la concentrazione espressa in moli litro-1. Le molecole di acqua non dissociate sono presenti in larghissimo eccesso e la concentrazione di acqua è praticamente costante, pari a: 1000 (g l -1 ) [H2O ] = = 55,5 mol l −1 -1 18,08 (g mol ) 1 A temperatura costante risulta costante anche il prodotto K [H2O] che viene indicato come KW ed è definito prodotto ionico dell’acqua. KW = [H+][OH-] Il prodotto ionico dell’acqua varia con la temperatura e cresce all’aumentare della temperatura perché il processo di ionizzazione è endotermico; a 25°C è: KW = 1,00⋅10-14 Nell’acqua pura gli ioni H3O+ ed OH- sono sempre presenti in numero uguale. A 25°C risulta: [H+] = [OH-] = 1,00⋅10-7 mol·l-1 In una qualunque soluzione acquosa gli ioni H3O+ sono i portatori del carattere acido e gli ioni OH- del carattere basico. L’acqua pura è chimicamente neutra perché le due specie hanno la stessa concentrazione. Se: [H+] = [OH-] ossia [H+] = 10-7 mol·l-1 la soluzione è NEUTRA [H+] > [OH-] ossia se [H+] > 10-7 mol·l-1 la soluzione è ACIDA [H+] < [OH-] ossia se [H+] < 10-7 mol·l-1 la soluzione è BASICA 2 Il carattere acido, basico o neutro di una soluzione può essere precisato mediante il valore di [H+]. Per comodità le concentrazioni vengono espresse in scala logaritmica introducendo una funzione della concentrazione degli ioni H3O+ chiamata pH, definita dalla relazione: pH = - Log10 [H+] Soluzione acida: [H+] > 10-7 mol·l-1 e pH < 7 Soluzione basica: [H+] < 10-7 mol·l-1 e pH > 7 Soluzione neutra: [H+] = 10-7 mol·l-1 e pH = 7 Lo stesso tipo di funzione può essere usato anche per la concentrazione degli ioni OH- : pOH = - Log10 [OH-] Per il prodotto ionico dell’acqua si ha: pKW = - Log10 KW = - (Log10 [H+] + Log10 [OH-]) ossia pKW = pH + pOH Per una qualunque soluzione acquosa a 25°C risulta: pH + pOH = 14 3 Teorie acido-base 1. 2. 3. Teoria di Arrhenius Teoria di Brönsted-Lowry Teoria di Lewis 1. Teoria di Arrhenius (1887) Una qualunque specie chimica che dissociandosi in soluzione acquosa fornisce ioni idrogeno è un acido, mentre una qualunque specie chimica che dissociandosi in una soluzione acquosa fornisce ioni idrossido è una base. Questa definizione comprende moltissimi acidi e basi comuni, come HCl, H2SO4, NaOH, Ca(OH)2, ecc. Tuttavia essa non riesce a spiegare le proprietà acide di sostanze come CO2, SO2 e le proprietà basiche di sostanze come NH3. ESTENSIONE DELLA TEORIA: un acido è una qualsiasi sostanza che in soluzione acquosa porta ad un aumento degli ioni idrogeno, una base è una qualsiasi sostanza che in soluzione acquosa porta ad un aumento della concentrazione degli ioni idrossido: CO2 + H2O HCO3- + H+ NH3 + H2O NH4+ + OH- LIMITAZIONI DELLA TEORIA: essa vale solo per soluzioni acquose e non consente una classificazione generale. 4 2. Teoria di Brönsted-Lowry (1923) Una qualunque specie chimica che si comporta come donatore di protoni è un acido, mentre una qualunque specie chimica che si comporta come accettore di protoni è una base. Questa definizione non è condizionata dalla natura del solvente. Un generico acido A1 cedendo un protone secondo l’equilibrio: A1 B1 + H+ si trasforma in B1, che prende il nome di base coniugata. Perché possa avvenire questo processo è necessaria la presenza di un’altra base B2 che sia in grado di accettare il protone. Accettando il protone, la base B2 si trasforma in A2, che prende il nome di acido coniugato, secondo lo schema: B2 + H+ A2 I due processi sono concomitanti: A1 + B2 B1 + A2 Questo processo, che avviene attraverso un trasferimento di protoni, è chiamato reazione acidobase o protolisi. ESEMPIO: HCN + H2O CN- + H3O+ (A1) (B2) (B1) (A2) NH3 + H2O (B1) (A2) NH4+ + OH(A1) (B2) 5 Quando il trasferimento di protoni avviene tra molecole della stessa specie la reazione è detta di autoprotolisi. Per esempio, la reazione di autoprotolisi dell’acqua può essere considerata una reazione acidobase, in cui una molecola di acqua si comporta da acido ed una molecola da base: H2O + H2O OH- + H3O+ (B2) (A1) (B1) (A2) Infatti la molecola di acqua può sia acquistare sia cedere un protone: + H+ - H+ comportamento acido OHH2O H3O+ comportamento basico In generale, questo comportamento è tipico delle specie chimiche in cui un atomo di idrogeno è legato ad un atomo molto elettronegativo recante una coppia di elettroni non condivisa. Questi composti, che possono comportarsi sia da acidi sia da basi, vengono detti anfoliti o elettroliti anfoteri. ESEMPI: comportamento acido NH2- comportamento acido S2- -H+ -H+ +H+ NH3 NH4+ HS- +H+ H2S comportamento basico comportamento basico I liquidi che non partecipano a processi di trasferimento di protoni (benzene, n-esano) sono definiti 6 aprotici. Forza degli acidi e delle basi Si definisce forza di un acido la sua tendenza a cedere protoni e forza di una base la sua tendenza ad acquistare protoni. Non si può parlare di forza di un acido o di una base in senso assoluto, ma solo in riferimento ad un altro acido o ad un’altra base assunti come termini di confronto. Considerando soluzioni acquose i termini di riferimento sono lo ione H3O+ per gli acidi e lo ione OH- per le basi. ACIDI e BASI FORTI Sono acidi più forti dell’acido H3O+ gli acidi che cedono all’acqua il loro protone ionizzandosi in modo completo: HCl + H2O Cl- + H3O+ (A1) (B2) (B1) (A2) HCl ha maggiore tendenza di H3O+ a cedere protoni e, viceversa, H2O ha maggiore tendenza di Cl– ad acquistare protoni: l’equilibrio è completamente spostato verso destra. H3O+ e Cl – sono acido e base più deboli di HCl e H2O rispettivamente. REGOLA GENERALE: le reazioni di trasferimento di protoni tendono ad avvenire nel senso che porta alla formazione dell’acido e della base più deboli. ESEMPI: HClO4 + H2O ClO4- + H3O+ H3O+ e ClO4– sono più deboli di HClO4 e H2O HNO3 + H2O NO3- + H3O+ H3O+ e NO3– sono più deboli di HNO3 e7H2O Gli acidi più forti di H3O+ in acqua appaiono tutti della stessa forza, a causa dell’effetto livellante dell’acqua. Per stabilire una scala di forza per essi è necessario considerare solventi che siano basi più deboli dell’acqua. La scala di acidità degli acidi forti più comuni è stata stabilita in CH3COOH al 100% e risulta: HClO4 > HI > HBr > H2SO4 > HCl > HNO3 Analoghe considerazioni valgono per le basi più forti della base OH- (NH2-, C2H5O-, ecc. ). Esse acquistano un protone dall’acqua e la reazione avviene in modo completo: NH2- + H2O (B1) (A2) NH3 + OH(A1) (B2) 8 ACIDI e BASI DEBOLI Gli acidi più deboli di H3O+ si ionizzano solo parzialmente in soluzione acquosa e danno origine ad un equilibrio la cui posizione è determinata dalla forza dell’acido rispetto a H3O+. CH3COOH + H2O CH3COO - + H3O+ Questo equilibrio è molto spostato verso sinistra. La costante di equilibrio, chiamata costante di ionizzazione o di dissociazione acida, presenta valori molto piccoli: Ka (CH 3COOH) [H O ]⋅ [CH COO ] = 1,76 ⋅10 = 3 a 25°C + 3 − [CH 3COOH ] −5 Analogamente, le basi più deboli di OH- danno luogo a reazioni di equilibrio: NH3 + H2O NH4+ + OH- La costante di equilibrio è detta costante di ionizzazione o di dissociazione basica: [NH ]⋅ [OH ] = 1,79 ⋅10 = + Kb (NH 3 ) a 25°C 4 [NH 3 ] − −5 9 Per una coppia acido-base coniugata si ha: Ka· Kb = KW Esempio: HCN-CN- coppia acido-base coniugata HCN + H2O CN- + H2O CN- + H3 HCN + O+ OH- Ka [H O ]⋅ [CN ] = Kb 3 + − [HCN ] [ HCN ] ⋅ [OH - ] = Ka· Kb = [H3O+][OH-] = KW [CN ] - ACIDI e BASI POLIPROTICI Un acido è detto monoprotico se può liberare un solo protone e poliprotico se può liberare più di un protone (diprotico, triprotico, ecc.). Una base è detta monoprotica se può fissare un solo protone e poliprotica se può fissare più di un protone (diprotica, triprotica, ecc.). ESEMPI: H2S + H2O HS- + H3O+ Ka,I ~ 10-7 HS- + H2O S2- + H3O+ Ka,II ~ 10-14 SO42 - + H2O HSO4- + OH - Kb,I ~ 10-12 HSO4- + H2O H2SO4 + OH - Kb,II ~ 10-17 REGOLA GENERALE: gli stadi successivi sono caratterizzati da costanti d’equilibrio via via 10 decrescenti. 3. Teoria di Lewis E’ una generalizzazione della teoria di Brönsted-Lowry e comprende anche processi in cui non avvengono trasferimenti di protoni. Un acido è una specie chimica contenente atomi con orbitali di valenza incompleti. Un acido è un accettore di elettroni. Una base è una specie chimica avente una o più coppie elettroniche non condivise. Una base è un donatore di elettroni. Viene definito complesso di coordinazione o addotto il composto che si forma tra una base ed un acido con condivisione di una coppia di elettroni in un legame: in questo caso si realizza la neutralizzazione della base con l’acido. Sono reazioni di neutralizzazione la reazione fra gli ioni OH- e H+: H+ + − .. :O:H .. → .. H:O: .. H e la reazione fra BF3 e NH3: F .. F:B .. F Acido H .. + :N:H .. H Base F H .. .. F:B:N:H .. .. F H complesso di coordinazione 11 Le basi di Brönsted sono anche basi di Lewis, ma gli acidi di Brönsted sono, negli schemi di Lewis, dei complessi di un acido con una base: l’acido è il protone e la base è la base coniugata di Brönsted. Le reazioni acido-base di Brönsted sono, secondo gli schemi di Lewis, reazioni nelle quali due basi diverse (H2O e Cl- nell’esempio seguente) si contendono lo stesso acido (H+), per formare il complesso acido-base più stabile (H3O+): H-Cl + complesso acido-base meno stabile H2O → base complesso acido-base più stabile H3O+ + Clbase Sono tipici acidi di Lewis: le sostanze che possono accettare un doppietto di elettroni avendo orbitali vuoti (BF3, AlCl3); i cationi dei metalli di transizione che hanno orbitali vuoti a bassa energia (Ag+, Cu2+); le molecole con legami multipli tra atomi di diversa elettronegatività (CO2, SO2, SO3). Sono tipiche basi di Lewis: gli ioni monoatomici negativi (F-, S2-); le molecole o gli ioni poliatomici che hanno coppie di elettroni non condivise (OH-, H2O, NH3, 12 CN -). Calcolo del pH di soluzioni di acidi e basi monoprotici ACIDI e BASI FORTI Un litro di soluzione acquosa contiene 1,00·10-3 moli di HClO4. Calcolare il pH della soluzione e le concentrazioni di tutte le specie presenti. 1. Individuare le reazioni presenti: HClO4 + H2O 2 H2O H3O+ + ClO4– H3O+ + OH– 2. Individuare le concentrazioni note e quelle incognite: La concentrazione iniziale di HClO4 è: [HClO4]0 = (1,00·10-3 mol / 1 l) = 1,00·10-3 mol/l Dal momento che HClO4 è un acido forte, completamente dissociato in soluzione, risulta: [ClO4–] = [HClO4]0 = c0 = 1,00·10-3 mol/l Le concentrazioni incognite sono: [H3O+] e [OH –] 3. Scrivere un numero di equazioni pari al numero delle incognite: a) KW = [H3O+] · [OH –] = 1,00·10-14 b) [H3O+] = [OH–] + [ClO4–] = [OH–] + c0 prodotto ionico dell’acqua condizione di elettroneutralità della soluzione 13 4. Risoluzione del sistema a 2 equazioni e 2 incognite: dalla b): [OH–] = [H3O+] – c0 sostituendo nella a): KW = [H3O+] · ([H3O+] - c0)= 1,00 ·10-14 si ricava: KW = [H3O+]2 - c0 [H3O+] [H3O+]2 - c0 [H3O+] – KW = 0 [H3 O+] = c0 ± (c 0 2 + 4K W 2 ) 5. Si può scegliere una risoluzione approssimata: ipotesi semplificative: la soluzione avrà un carattere acido. Se [H3O+]>> [OH –] è possibile trascurare [OH–] nella equazione b): quindi, [H3O+] = [ClO4–]. Questa approssimazione significa trascurare gli ioni H3O+ derivanti dall’autoprotolisi dell’acqua. [H3O+] = [ClO4–] = c0 = 1,00 ·10-3 M pH = -Log10 [H3O+] = 3,00 (pH acido) Dalla a): [OH –] = KW / [H3O+] = 1,00 ·10-14 / 1,00 ·10-3 =1,00 ·10-11 mol/l da cui: [OH –] << [H3O+] (ipotesi verificata) 14 Questa risoluzione approssimata è lecita per valori di c0 > 1,00 · 10-6 mol/l. Infatti nell’equazione di secondo grado [H3 O+] = c0 ± (c 0 2 2 + 4K W ) per c0 > 1,00 · 10-6 mol/l il secondo termine sotto radice (4KW) è trascurabile rispetto al primo (c02), per cui: [H3O+] = c0 Quindi per acidi e basi forti, se la concentrazione iniziale della acido [Acido]0 o della base [Base]0 è > 10-6 M, si possono trascurare gli ioni H3O+ o OH- derivanti dall’autoprotolisi dell’H2O. Allora: per soluzioni acide: [H3O+] = [Acido]0 pH = -Log10 [Acido]0 per soluzioni basiche: [OH-] = [Base]0 pOH = -Log10 [Base]0 Se la concentrazione iniziale è < 10-6 M, non si può trascurare l’autoprotolisi dell’H2O e quindi non si possono fare approssimazioni e si risolve l’equazione di 2°grado. 15 Calcolare il pH di una soluzione di HCl 1,00 ·10-8 M. Il pH non può essere calcolato applicando direttamente la relazione: pH = -Log10 [Acido]0 = - Log10 1,00 ·10-8 = 8,00 perché la soluzione risulterebbe basica. In questo esempio, data la bassa concentrazione dell’acido, non si può trascurare l’autoprotolisi dell’acqua. 1. Individuare le reazioni presenti: H3O+ + Cl– HCl + H2O 2 H2O H3O+ + OH– 2. Individuare le concentrazioni note e quelle incognite : Dal momento che HCl è un acido forte, completamente dissociato in soluzione, risulta: [Cl–] = [HCl]0 = c0 = 1,00 · 10-8 mol/l Le concentrazioni incognite sono: [H3O+] e [OH–] 3. Scrivere un numero di equazioni pari al numero delle incognite: a) KW = [H3O+] · [OH–] = 1,00 ·10-14 b) [H3O+] = [OH–] + [Cl–] = [OH–] + c0 condizione di elettroneutralità della 16 soluzione prodotto ionico dell’acqua 4. Risoluzione del sistema a 2 equazioni e 2 incognite: dalla b): [OH–] = [H3O+] – c0 sostituendo nella a): KW = [H3O+] · ([H3O+] – c0 )= 1,00 ·10-14 si ricava: KW = [H3O+]2 - c0 [H3O+] [H3O+]2 - c0 [H3O+] – KW = 0 [H3O+] = 1,05 ·10-7 mol/l pH = - Log10 [H3O+] = 6,98 (pH leggermente acido) [OH –] = KW / [H3O+] = (1,00 ·10-14 / 1,05 ·10-7) = 9,52 ·10-8 mol/l 17 BASE FORTE Calcolare il pH di una soluzione di NaOH 8,32·10-2 M. 1. Individuare le reazioni presenti: NaOH Na+ + OH– 2 H2O H3O+ + OH– 2. Individuare le concentrazioni note e quelle incognite : Dal momento che NaOH è una base forte, completamente dissociata in soluzione, risulta: [Na+] = [NaOH]0 = c0 = 8,32 · 10-2 mol/l Le concentrazioni incognite sono: [H3O+] e [OH–] 3. Scrivere un numero di equazioni pari al numero delle incognite: a) KW = [H3O+] · [OH–] = 1,00 ·10-14 b) [H3O+] + [Na+] = [OH–] prodotto ionico dell’acqua condizione di elettroneutralità della soluzione 4. Si possono fare delle ipotesi semplificative: la soluzione avrà un carattere basico. Se [OH–]>> [H3O+] posso trascurare [H3O+] nella equazione b): quindi, [Na+] = [OH–]. Questa approssimazione significa trascurare gli ioni OH– derivanti dall’autoprotolisi dell’acqua. [Na+] = [OH–] = 8,32 ·10-2 M pOH = 1,08 [H3 O+] = 1,2 pH = 14- pOH = 12,9 (pH basico) ·10-13 M << [OH–] (ipotesi verificata) 18 ACIDI e BASI DEBOLI Calcolare il pH e le concentrazioni delle specie presenti all’equilibrio di una soluzione 1,00 M di CH3COOH, sapendo che la sua costante di dissociazione è Ka= 1,76 ·10-5. 1. Individuare le reazioni presenti: CH3COOH + H2O CH3COO– + H3O+ H3O+ + OH– 2 H2O 2. Individuare le concentrazioni incognite: [CH3COOH], [CH3COO–], [H3O+] e [OH–] 3. Scrivere un numero di equazioni pari al numero delle incognite: a) KW = [H3O+] · [OH–] = 1,00 · 10-14 prodotto ionico dell’acqua [H O ]⋅ [CH COO ] = 1,76 ⋅10 = 3 + 3 − −5 b) Ka c) [H3O+] = [CH3COO–] + [OH–] d) [CH3COOH]0 = [CH3COO–] + [CH3COOH]= 1,00 M (CH 3COOH) [CH3COOH ] costante di dissoc. acida elettroneutralità della soluzione bilancio di materia 19 4. Si possono fare delle ipotesi semplificative: la soluzione avrà un carattere acido, cioè [H3O+]>> [OH–]. Quindi è possibile trascurare [OH–] nella equazione c). Inoltre Ka>>KW, quindi è possibile trascurare gli ioni H3O+ derivanti dall’autoprotolisi dell’acqua. Ottengo un sistema semplificato: a) Ka (CH 3COOH) [H O ]⋅ [CH COO ] = 1,76 ⋅10 = 3 + 3 − [CH3COOH ] −5 b) [H3O+] = [CH3COO–] c) [CH3COOH]0 = [CH3COO–] + [CH3COOH]= 1,00 M 5. Risoluzione del sistema: dalla c): [CH3COOH]= [CH3COOH]0 - [CH3COO–] = [CH3COOH]0 - [H3O+] sostituendo nella a): Ka (CH 3COOH) = [H O ] 3 + 2 [CH3COOH ]0 − [H3O + ] = 1,76 ⋅10 −5 risolvendo l’equazione di 2° si ricava: [H3O+] = 4,19 ·10-3 M pH = 2,38 (pH acido) 20 6. Calcolo delle concentrazioni di tutte le specie presenti. [OH–] = (KW / [H3O+]) = (1,00 ·10-14 / 4,19 ·10-3) = 2,39 ·10-12 mol/l E’ verificata l’ipotesi [H3O+]>> [OH–]. [CH3COO–] = [H3O+] = 4,19 ·10-3 mol/l [CH3COOH]= [H3O+ ] ⋅ [CH3COO − ] = 0,998 mol/l Ka 21 Calcolare il pH e le concentrazioni delle specie presenti in una soluzione ottenuta sciogliendo 0,5 g di NH3 in 3 litri di soluzione, sapendo che Kb= 1,79 10-5. 1. Individuare le reazioni presenti: NH3 + H2O 2 H2O NH4+ + OH – H3O+ + OH – 2. Individuare le concentrazioni note e quelle incognite : [NH3]0 = [0,5 g / (17 g/mol ·3l)] = 0,01 mol/l concentrazioni incognite: [NH3], [NH4+], [H3O+] e [OH–] 3. Scrivere un numero di equazioni pari al numero delle incognite: a) b) KW = [H3O+] · [OH–] = 1,00 ·10-14 Kb [NH ]⋅ [HO = 4 + [NH3 ] − ] = 1,79 ⋅ 10 −5 prodotto ionico dell’acqua costante di dissoc. basica c) [H3O+] + [NH4+] = [OH–] elettroneutralità della soluzione d) [NH3]0 = [NH3] + [NH4+] bilancio di materia 22 4. Si possono fare delle ipotesi semplificative: la soluzione avrà un carattere basico, cioè [OH–] >>[H3O+]. Quindi è possibile trascurare [H3O+] nella equazione c). Inoltre Kb>>KW, quindi è possibile trascurare gli ioni OH– derivanti dall’autoprotolisi dell’acqua. Ottengo un sistema semplificato: a) + [ OH− ] ⋅ [NH4 ] Kb = = 1,79 ⋅ 10 −5 [NH3 ] b) [NH4+] = [OH–] c) [NH3]0 = [NH3] + [NH4+] 5. Risoluzione del sistema: dalla c): [NH3]= [NH3]0 - [NH4+] = [NH3]0 - [OH–] sostituendo nella a): 2 [ OH− ] = 1,79 ⋅ 10 −5 Kb = [NH3 ]0 − [OH − ] risolvendo l’equazione di 2° si ricava: [OH–] = 4,14 ·10-4 M pOH = 3,38 pH = 14 - pOH = 10,62 (pH basico) 23 6. Calcolo delle concentrazioni di tutte le specie presenti. [H3O+] = (KW / [OH–]) = (1,00 ·10-14 / 4,14 ·10-4) = 2,41 ·10-11 mol/l E’ verificata l’ipotesi [OH–] >> [H3O+]. [NH4+] = [OH–] = 4,14 ·10-4 mol/l [OH ]⋅ [NH ] = 0,0096 mol/l − [NH3]= + 4 Kb 24 Calcolo di pH in sistemi in cui avvengono reazioni di neutralizzazione Viene chiamata reazione di neutralizzazione la reazione stechiometrica di un acido con una base. Calcolare il pH e le concentrazioni delle specie presenti in una soluzione ottenuta miscelando 7,42·10-2 l di una soluzione acquosa 0,400 M in HCl con 8,21·10-2 l di una soluzione acquosa 0,420 M in NaOH. 1. Individuare le reazioni presenti: HCl + H2O H3O+ + Cl– NaOH Na+ + OH– 2 H2O H3O+ + OH – 2. Individuare le concentrazioni note e quelle incognite : Il numero di moli di HCl introdotte (soluzione 1) sono: n0, HCl= M1·V1 = (0,400 mol/l · 7,42·10-2 l) = 2,97·10-2 mol Il numero di moli di NaOH introdotte (soluzione 2) sono: n0, NaOH= M2·V2 = (0,420 mol/l · 8,24·10-2 l) = 3,45·10-2 mol Le concentrazioni iniziali di HCl e NaOH (nella soluzione complessiva) risultano: [HCl]0 = [n0, HCl / (V1 +V2)] = [ 2,97·10-2 mol / 1,56·10-1 l ] = 1,90 ·10-1 mol/l [NaOH]0 = [n0, NaOH / (V1 +V2)] = [ 3,45·10-2 mol / 1,56·10-1 l ] = 2,21 ·10-1 mol/l 25 Dal momento che HCl e NaOH sono entrambi forti, cioè completamente dissociati in acqua, risulta: [Cl-] = [HCl]0 = 1,90 · 10-1 mol/l [Na+] = [NaOH]0 = 2,21 · 10-1 mol/l Le concentrazioni incognite sono: [H3O+] e [OH–] 3. Scrivere un numero di equazioni pari al numero delle incognite: a) KW = [H3O+] · [OH–] = 1,00 ·10-14 b) [H3O+] + [Na+] = [OH–] + [Cl–] prodotto ionico dell’acqua condizione di elettroneutralità della soluzione 4. E’ possibile fare un’ipotesi semplificativa, considerando il fatto che [NaOH]0 > [HCl]0. Si può considerare basica la soluzione finale ([H3O+] < 10-7 << [Na+]), per cui è possibile trascurare [H3O+] nella equazione b). Ciò equivale a trascurare gli ioni H3O+ provenienti dall’autoprotolisi dell’acqua. Il sistema si riduce ad una sola equazione: [Na+] = [OH–] + [Cl–] 26 Risulta: [OH–] = [Na+] - [Cl–] = (2,21 · 10-1 mol/l - 1,90 · 10-1 mol/l ) = 3,10 · 10-2 mol/l pOH = - Log10 [OH–] = 1,51 pH = 14 - pOH = 12,49 (pH basico) [H3O+] = (KW / [OH–]) = (1,00 ·10-14 / 3,10 ·10-2) = 3,23 ·10-13 mol/l E’ verificata l’ipotesi [H3O+]<< [Na+] ed è quindi giustificata l’approssimazione. 27 IDROLISI L’idrolisi è una reazione di scambio protonico (reazione acido-base) che può avvenire quando un sale viene disciolto in acqua. L’acqua può reagire con gli anioni o i cationi che costituiscono il sale, nel caso in cui la reazione porti alla formazione di acidi deboli o basi deboli. Il pH finale varia in funzione delle caratteristiche del sale. Esempi: soluzione sale pH a) NaCl =7 soluzione neutra b) NaCN >7 soluzione basica c) NH4Cl <7 soluzione acida In soluzione i sali si dissociano completamente: a) NaCl Na+ + Cl- b) NaCN Na+ + CN- c) NH4Cl NH4+ + Cl- 28 Soluzione a): le reazioni fra Na+ e Cl – e l’acqua porterebbero in teoria a: Na+ + H2O NaOH + H+ Cl– + H2O HCl + OH– ma sia NaOH sia HCl, essendo base e acido forti, sono completamente dissociati in acqua, per cui le due reazioni indicate non possono verificarsi. Per questo motivo il pH risulta neutro. Soluzione b): Na+ non reagisce con H2O; CN – reagisce con H2O fornendo l’acido debole HCN. Si forma il seguente equilibrio: CN– + H2O HCN + OH– idrolisi basica L’eccesso di ioni OH– rende la soluzione basica: pH > 7. Soluzione c): Cl– non reagisce con H2O; NH4+ reagisce con H2O fornendo la base debole NH3. Si forma il seguente equilibrio: NH4+ + H2O NH3 + H3O+ idrolisi acida L’eccesso di ioni H3O+ rende la soluzione acida: pH < 7. 29 I valori delle costanti di equilibrio relative agli equilibri di idrolisi si calcolano immediatamente noti i valori dei corrispondenti Ka e Kb: CN - + H2O HCN + OH – idrolisi basica Ki, CN- = KW / Ka, HCN NH4+ + H2O NH3 + H3O+ idrolisi acida Ki, NH + = KW / Kb, NH 4 3 [ HCN ]⋅ [OH - ] Ki = Infatti: [CN ] [CN ]⋅ [H O ] [ CN ]⋅ [H O ] = - con Ka - (HCN) HCN ]⋅ [OH - ]⋅ [H 3O + ] K w [ = = 3 [HCN ] - 3 + Ka + 30 Soluzioni tampone Sono soluzioni contenenti un acido debole ed un suo sale (CH3COOH e CH3COONa) oppure una base debole ed un suo sale (NH3 e NH4Cl) in concentrazioni simili ed abbastanza elevate. Hanno la caratteristica di mantenere il pH pressoché costante quando ad esse si aggiungono piccole quantità di un acido o di una base forti. Tali soluzioni sono chiamate tampone e l’azione tamponante è dovuta ad equilibri acido-base. Esempio: soluzione acquosa di CH3COOH e CH3COOK CH3COOK CH3COO– + K+ Equilibri presenti in soluzione: 1) CH3COOH + H2O CH3COO– + H3O+ Ka, CH 2) CH3COO– + H2O CH3COOH + OH– Kb, CH 3) 2 H2O H3O+ + OH– 3COOH 3COO KW Azione tampone: aggiunta ioni H3O+ gli ioni vengono sottratti alla soluzione poiché reagiscono con CH3COO–: CH3COO– + H3O+ aggiunta ioni OH – CH3COOH + H2O gli ioni vengono sottratti alla soluzione poiché reagiscono con CH3COOH: CH3COOH + OH– CH3COO– + H2O Ne consegue che il pH rimane praticamente costante. 31
Scaricare