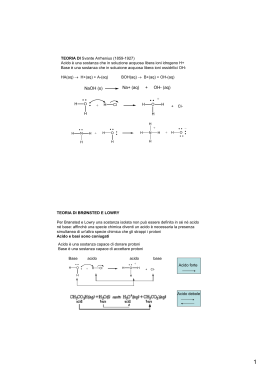
Chimica Organica – Acidità -‐ Basicità 1) Qual è l’acido coniugato delle basi elencate di seguito? 1. CH3CHO 2. Cl– 3. HO– 4. H2O 5. CH3COO-‐ 6. CH3NH2 Soluzione 1a: 7. NH3 2) Qual è l’acido più forte tra a. un acido con pKa di 5.2 e un acido con pKa di 5.8? b. un acido con costante di dissociazione Ka di 3.4 × 10–3 e un acido con costante di dissociazione Ka di 2.1 × 10–4? 3) Un acido ha un valore di Ka di 4.53 × 10–6 in acqua. Qual è il valore di Keq per la reazione con acqua in soluzione diluita? (Suggerimento: ricordare qual è la differenza tra la costante di equilibrio Keq e la costante di acidità Ka per un acido debole; il valore di [H2O] = 55.5 M) 4) L’acido butirrico, il composto responsabile dell’odore e sapore sgradevole del latte inacidito, ha un pKa di 4.82. Qual è il suo valore di Ka? È un acido più forte o più debole rispetto alla vitamina C la cui Ka è di 6.8 × 10–5? 5) Disegnare l’acido coniugato di ciascuna delle molecole elencate: 6) Scrivere la reazione chimica che mostra a. il metanolo che reagisce come acido con NH3 b. il metanolo che reagisce come base con HCl. c. l’ammoniaca che reagisce come acido con CH3O– d. l’ammoniaca che reagisce come base con HBr. 7) Disporre i seguenti composti in ordine di acidità crescente a. CH3CH2CH2NH2 b. CH3CH2COOH c. CH3CH2CH2OH d. CH3CH2CH2NH3 8) Quale atomo si protona più facilmente nel 3-‐ammino-‐1-‐propanolo (HOCH2CH2CH2NH2)? Soluzione: una possibile strategia di soluzione è quella di confrontare il valore di pKa dell’acido coniugato del gruppo da protonare, ricordando che l’acido più debole ha la base coniugata più forte. La base più forte si protonerà più facilmente. 9) Qual è la base più forte tra le due? a. CH3COO– o HCOO– ? (per CH3COOH pKa= 4.8; per HCOOH pKa=3.8) b. OH − o NH −2 ? (per H2O pKa= 15.7; per NH3 pKa= 36) c. H2O o CH3OH? (per H3O+ pKa= –1.7; per CH 3OH +2 pKa= –2.5) 10) Disporre le seguenti basi in ordine crescente di forza: 11) Dire se il metanolo (pKa=15,5) si comporta da acido o da base nei confronti della metilammina (pKa=40)? 12) L’etino ha pKa = 25, l’acqua ha pKa = 15.7 e ammoniaca (NH3) ha pKa = 36. Disegnare l’equazione, mostrando con le frecce se sono favoriti i reagenti, oppure i prodotti, per la reazione acido-‐base tra l’etino e: a. OH − b. NH −2 c. Quale sarebbe la base migliore se si volesse deprotonare l’etino, l’ OH - oppure l’ NH -2 ? 13) Quale delle seguenti basi può rimuovere un protone dall’acido acetico in una reazione che favorisce i prodotti? a. OH − b. CH3NH2 c. HC ≡ C− d. CH3OH e. H2O f. Cl− 14) Mettere in ordine crescente di basicità i seguenti ioni: CH −3 NH −2 OH − F − 15) Disegnare il prodotto delle seguenti reazioni 16) Facendo riferimento alle reazioni acido-‐base del punto precedente, indicare in quale di esse è favorita la formazione del prodotto. 17) a. A quale pH la concentrazione della forma basica di un composto con pKa = 8.4 è 100 volte maggiore rispetto alla sua forma acida? b. A quale pH la concentrazione della forma acida di un composto con pKa = 3.7 è 10 volte maggiore rispetto alla sua forma basica? c. A quale pH la concentrazione della forma acida di un composto con pKa = 8.4 è 100 volte maggiore rispetto alla sua forma basica? d. A quale pH il 50% di un composto con pKa = 7.3 è nella sua forma basica? e. A quale pH la concentrazione della forma basica di un composto con pKa = 4.6 è 10 volte maggiore rispetto alla sua forma acida? Soluzione 17a: Se la concentrazone della forma basica è 100 volte maggiore rispetto alla concentrazione della forma acida, l’equazione di Henderson–Hasselbalch diventa: pH = pKa – log 1 ∕100 pH = 8.4 – log 0.01 pH = 8.4 + 2.0 pH = 10.4 18) Indicare il sale che è la base più forte. A CH3CH(OCH3)CO2– Na+. B (CH3)2CHCO2– Na+. C CH3CHBrCO2– Na+. D CH3CHFCO2– Na+. 19) Mettere i seguenti composti in ordine di acidità. (1) Fenolo; (2) p-‐Etossifenolo; (3) p-‐Nitrofenolo. A 3 > 2 > 1. B 1 > 2 > 3. C 3 > 1 > 2. D 2 > 1 > 3. 20) Mettere i seguenti composti in ordine di acidità. (1) Acido benzoico; (2) Acido p-idrossibenzoico; (3) Acido m-cianobenzoico. 21) 22) 23) 24) 25) A 3 > 2 > 1. B 1 > 2 > 3. C 3 > 1 > 2. D 2 > 1 > 3. Indicare l’acido carbossilico più forte. A Acido p-‐etossibenzoico. B Acido benzoico. C Acido p-‐nitrobenzoico. D Acido p-‐propilbenzoico. Indicare quale ordine di basicità è corretto. (1) p-‐Metilanilina > Anilina; (2) p-‐Nitroanilina > p-‐Metossianilina. A 1 = Sì; 2 = Sì. B 1 = Sì; 2 = No. C 1 = No; 2 = Sì. D 1 = No; 2 = No. Indicare l’acido più forte. A p-‐Etossifenolo. B Fenolo. C m-‐Metilfenolo. D m-‐Clorofenolo. Indicare la base più debole. A Anilina. B p-‐Bromoanilina. C p-‐Metilanilina. D p-‐Metossianilina. Indicare l’acido carbossilico più debole. A CH3CH2CO2H. B BrCH2CO2H. C ICH2CO2H. D CH3CO2H. 26) Sapendo che il pKa dell’acido benzoico è 4.18, assegnare ai seguenti acidi un valore di pKa inferiore o superiore a 4.18. (1) p-‐HCO(C6H4)CO2H; (2) p-‐H2NCO(C6H4)CO2H. A 1 = Inferiore; 2 = Inferiore. B 1 = Inferiore; 2 = Superiore. C 1 = Superiore; 2 = Inferiore. D 1 = Superiore; 2 = Superiore. 27) Sapendo che il pKa dell’anilina è 4.5, assegnare ai seguenti composti un valore di pKa inferiore o superiore a 4.5 (1) p-‐Amminofenolo; (2) m-‐Amminofenolo. A 1 = Inferiore; 2 = Inferiore. B 1 = Inferiore; 2 = Superiore. C 1 = Superiore; 2 = Inferiore. D 1 = Superiore; 2 = Superiore. 28) Sapendo che il pKa dell’acido benzoico è 4.18, assegnare ai seguenti acidi un valore di pKa inferiore o superiore a 4.18. (1) p-‐H3CO(C6H4)CO2H; (2) p-‐HCO(C6H4)CO2H. A 1 = Inferiore; 2 = Inferiore. B 1 = Inferiore; 2 = Superiore. C 1 = Superiore; 2 = Inferiore. D 1 = Superiore; 2 = Superiore. 29) Mettere i seguenti composti in ordine di acidità. (1) Fenolo; (2) p-‐Nitrofenolo; (3) p-‐Metilfenolo. A 1 > 2 > 3. B 2 > 1 > 3. C 2 > 3 > 1. D 3 > 2 > 1. 30) Indicare l’acido più debole. A m-‐Etossifenolo. B p-‐Bromofenolo. C Fenolo. D p-‐Metossifenolo. 31) Prevedere in quale forma si troveranno i seguenti composti in una soluzione a pH = 7. (1) (2) CH3CO2H = CH3CO2– + H+ (pKa = 4.8); CH3CHOH+ = CH3CHO + H+ (pKa = -8). A 1 = Neutra; 2 = Neutra. B 1 = Neutra; 2 = Cationica. C 1 = Anionica; 2 = Neutra. D 1 = Anionica; 2 = Cationica. 32) Indicare l’acido carbossilico più forte. A FCH2CO2H. B ClCH2CO2H. C ICH2CO2H. D CH3CH2CO2H. 33) Indicare dove è spostato il seguente equilibrio acido-‐base. p-Metossianilina + cloruro di p-nitroanilinio = Cloruro di p-metossianilinio + p-nitroanilina A C Destra. Dipende dal solvente. D B Sinistra. Dipende dalla temperatura. 34) Mettere i seguenti composti in ordine di basicità. H NH2 NH2 1 N 2 3 A 3 > 1 > 2. B 3 > 2 > 1. C 1 > 2 > 3. 35) Mettere i seguenti composti in ordine di acidità. (1) Acido p-idrossibenzoico; formilbenzoico. 36) 37) 38) 39) 40) (2) Acido D benzoico; 2 > 1 > 3. (3) Acido p- A 3 > 2 > 1. B 1 > 2 > 3. C 3 > 1 > 2. D 2 > 1 > 3. Sapendo che il pKa del fenolo è 10.5, assegnare ai seguenti composti un valore di pKa inferiore o superiore a 10.5. (1) p-‐Nitrofenolo; (2) p-‐Bromofenolo. A 1 = Inferiore; 2 = Inferiore. B 1 = Inferiore; 2 = Superiore. C 1 = Superiore; 2 = Inferiore. D 1 = Superiore; 2 = Superiore. Sapendo che il pKa dell’anilina è 4.5, assegnare ai seguenti composti un valore di pKa inferiore o superiore a 4.5 (1) p-‐Amminofenolo; (2) m-‐Amminobenzaldeide. A 1 = Inferiore; 2 = Inferiore. B 1 = Inferiore; 2 = Superiore. C 1 = Superiore; 2 = Inferiore. D 1 = Superiore; 2 = Superiore. Sapendo che il pKa dell’acido benzoico è 4.18, assegnare ai seguenti acidi un valore di pKa inferiore o superiore a 4.18. (1) p-‐H3C(C6H4)CO2H; (2) p-‐HCO(C6H4)CO2H. A 1 = Inferiore; 2 = Inferiore. B 1 = Inferiore; 2 = Superiore. C 1 = Superiore; 2 = Inferiore. D 1 = Superiore; 2 = Superiore. Mettere i seguenti composti in ordine di basicità. (1) Anilina; (2) p-‐Metossianilina; (3) p-‐Bromoanilina. A 3 > 2 > 1. B 1 > 2 > 3. C 3 > 1 > 2. D 2 > 1 > 3. Mettere i seguenti composti in ordine di acidità. (1) Fenolo; (2) p-‐Metossifenolo; (3) p-‐Idrossibenzaldeide. A 3 > 2 > 1. B 1 > 2 > 3. C 3 > 1 > 2. D 2 > 1 > 3. 41) Sapendo che il pKa del fenolo è 10.5, assegnare ai seguenti composti un valore di pKa inferiore o superiore a 10.5. (1) p-‐Metossifenolo; (2) p-‐Idrossibenzaldeide. A 1 = Inferiore; 2 = Inferiore. B 1 = Inferiore; 2 = Superiore. C 1 = Superiore; 2 = Inferiore. D 1 = Superiore; 2 = Superiore. 42) Mettere i seguenti composti in ordine di acidità. (1) Acido p-‐metossibenzoico; (2) Acido m-‐nitrobenzoico; (3) Acido benzoico. A 2 > 3 > 1. B 1 > 2 > 3. C 3 > 1 > 2. D 2 > 1 > 3. 43) Mettere i seguenti composti in ordine di acidità. (1) Fenolo; (2) p-‐Idrossibenzaldeide; (3) p-‐Etossifenolo. A 1 > 2 > 3. B 2 > 1 > 3. C 2 > 3 > 1. D 3 > 2 > 1. 44) Indicare quale, tra questi acidi carbossilici, è il più debole. A Acido benzoico. B Acido p-‐cianobenzoico. C Acido p-‐formilbenzoico. D Acido p-‐metilbenzoico. 45) Mettere i seguenti composti in ordine di basicità. (1) Anilina; (2) p-‐Metossianilina; (3) p-‐Nitroanilina. A 3 > 2 > 1. B 1 > 2 > 3. C 3 > 1 > 2. D 2 > 1 > 3. 46) Indicare la base più debole. A p-‐Metossianilina. B Anilina. C p-‐Bromoanilina. D Etilammina. 47) Indicare l’acido carbossilico più debole. A ICH2CO2H. B CH3CH2CO2H. C ClCH2CO2H. D BrCH2CO2H. 48) Indicare l’acido più forte.
Scaricare