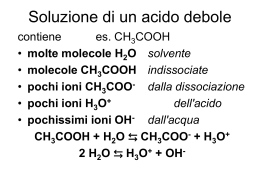
PON C4 "LE SCIENZE IN … GARA!" Approfondimenti di Chimica e Biologia: pH, pOH, soluzioni tampone, acidi monoprotici e poliprotici, acido acetico, acetati, ammine, ammidi. prof. Ciro Formica Calcolo della concentrazione di H+ e OH- di acidi e basi poliprotiche (che liberano più di un H+ e OH-) Es. 1 H2SO4(aq) concentraz. 0,005M (5*10-3 M) Calcola H+ e pH L’acido solforico è molto forte e all’equilibrio risulterà interamente ionizzato (è un composto polare): H2SO4(aq) ↔ 2H+ + SO42- inizio 5*10-3 M 0 0 equilibrio 0 2*5*10-3 M = 10-2 M 5*10-3 M Es. 2 pH = -log 10 -2 = -log 0,01 = 2 Ca(OH)2(aq) concentrazione 0,001M (10-3 M) Calcola OH-, pOH e pH L'idrossido di calcio è una base molto forte e all’equilibrio risulterà interamente dissociata: Ca(OH)2(aq) ↔ Ca2+ + 2OH- inizio 10-3 M 0 0 equilibrio 0 10-3 M 2*10-3 M pOH = -log(2*10-3) = 2,70 ATTENZIONE! pH = 14-pOH = 11,30 Negli acidi e le basi poliprotiche -che liberano più H+ e OH- - si moltiplicano le moli per il numero di H+ e OH- Calcolo della concentrazione di H+ o OH- di acidi/basi forti di cui sia noto il pH Es. 3 NaOH(aq) calcola la massa di NaOH contenuta in 250 mL di una soluzione a pH=12 [H+]=10-pH = 10-12 [OH-]=Kw/[H+] [OH-]=10-14/10-12=10-2 NaOH(aq) ↔ Na+ + OH- inizio 10-2 M 0 0 equilibrio 0 10-2 M 10-2 M 250 mL=0,25L n=0,25*0,01=0,0025 mol m=mol*MM m=0,0025*40= 0,1g Calcolo del pH o pOH di una soluzione tampone Calcolo del pH di una soluzione tampone ottenuta mescolando 75 mL CH3COOH 0,01 M+ 25 mL NaOH Es. 4 0,01 M. Ka = 1,8*10-5 reazione: idrolisi del sale: CH3COOH + NaOH ↔ CH3COONa CH3COONa + ↔ H2O CH3COO- + H+ Il tampone è formato da un acido debole (CH 3COOH) e un suo sale di base forte, l'acetato di sodio CH 3COONa. Poiché l'acetato di sodio si idrolizza completamente, la sua concentrazione Cs è identica a quella dell'anione acetato CH 3COOcalcolo volumi: 75 mL = 0,075 L; 25 mL = 0,025 L. Vtot=0,1 L moli CH3COOH iniziali= 0.01•0.075= 7,5•10 -4 moli CH3COONa formate= 0.01•0.025= 2,5•10 -4 moli CH3COOH che non hanno reagito= 7,5-2,5=5•10 -4 CH3COONa ↔ CH3COO- + H+ l'acetato di sodio si dissocia liberando anioni acetato, la cui concentrazione corrisponde a quella del sale di provenienza (Cs) = 2,5•10-4 CH3COOH ↔ CH3COO- + H+ l'acido etanoico (acetico) si ionizza (è polare) liberando solo un catione H + poiché è un acido MONOPROTICO [CH3COOH] = 5•10-4/0,1 = 5•10-3 = 0,005 M → Ca [CH3COO-] = 2,5•10-4/0,1 = 2,5•10-3 = 0,0025 M → Cs Dalla eq. Di HendersonHasselbalch si ricava: pH = pKa + log Cs/Ca Si noti che se Cs=Ca, il rapporto Cs/Ca=1; log1=0 quindi pH = pK dove pKa = -log (1,8*10-5) = 4,75 pH = 4,75+ log 0,0025/0,005 = 4,45 Calcolo del pOH di una soluzione tampone ottenuta mescolando 100 mL NH3 0,001 M+ 150 mL NH4Cl 0,001 Es. 5 M. Kb = 1,8*10-5 NH3 + H2O ↔ NH4OH base debole Il tampone è formato da una base debole (NH 4OH) e un suo sale di acido forte (NH4Cl). Poiché il cloruro d'ammonio NH4Cl si idrolizza completamente la sua concentrazione Cs sarà identica a quella del catione ammonio NH 4+ calcolo volumi: 100 mL = 0,1 L; 150 mL = 0,15 L. Vtot=0,25 L moli NH4OH= 0.1•0.001= 1•10-4 NH4Cl ↔ NH4+ + Cl- il cloruro di ammonio si dissocia liberando cationi ammonio, la cui concentrazione corrisponde a quella del sale di provenienza Cs = 0,0006 = 6•10 -4 moli NH4Cl= 0.15•0.001= 1,5•10-4 [NH4OH] = 1•10-4/0,25 = 0,0004 M → Cb [NH4+]= 1,5•10-4/0,25 = 0,0006 M → Cs Dalla eq. Di HendersonHasselbalch si ricava: pOH = pKb + log Cs/Cb Si noti che se Cs=Cb, il rapporto Cs/Cb=1; log1=0 quindi pH = pK dove pKb = -log (1,8*10-5) = 4,75 pOH = 4,75+ log 0,0006/0,0004 = 4,92 pH = 14-4,92 = 9,07 Approfondimenti di chimica organica e biochimica CH3COOH ↔ CH3COO- + H+ l'acido etanoico (acetico) si ionizza (è polare) liberando solo un catione H + poiché è un acido MONOPROTICO CH3COOH + CH3CH2NH2 → CH3-CO-NH2 + CH3CH2-OH Dalla reazione tra acido etanoico (acetico) e un'ammina (etanammina) si forma un'AMMIDE (etanammide o acetammide) il cui gruppo funzionale è evidenziato in rosso, e un alcol (etanolo) AMMIDI: la struttura di questa classe di composti organici deriva da quella degli acidi carbossilici in cui, al posto dell’ OH del gruppo carbossilico, è legato un gruppo -N-H 2 (ammidi primarie): R-CO-NH2. Ammidi secondarie: R-CO-NHR, terziarie: R-CO-NR2. AMMIDI: l'UREA è una particolare ammide: NH2-CO-NH2: è dotata di 2 gruppi amminici primarie: R-NH2 secondarie: R-NH-R' terziarie: R-N(R')-R" ammonio quaternario: R4-N+ AMMINE: questa classe di composti organici deriva principalmente dalla reazione tra un alogenuro alchilico (o aromatico) e l'ammoniaca NH3 : CH3-Cl + NH3 --> CH3-NH2 + HCl proprietà delle AMMINE: aono in massima parte dovute al doppietto elettronico dell'azoto (electron pair) non condiviso: 1- solubilità in acqua formano legami a idrogeno 2- basicità: in acqua liberano OH- R-NH2 + H2O --> R-NH3+ + OH- 3- punto di ebollizione più alto dei corrispondenti alcani ma più basso degli alcoli 4- proprietà nucleofile formano legami a idrogeno l'electron pair (doppietto di non legame) si rende disponibile per altri composti La basicità decresce dalle terziarie (le più alcaline) alle secondarie alle primarie all'ammoniaca Sono ammine numerosi composti dotati di attività biologica: DOPAMINA, ADRENALINA, SEROTONINA ecc.
Scaricare