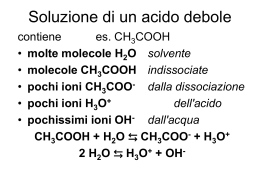
13/12/2012 Equilibrio acido base In genere, per risolvere gli esercizi, ci basta la Teoria di Brønsted-Lowry: Un acido è una sostanza che cede ioni idrogeno (protoni) trasformandosi nella sua base coniugata + − AH ⇔ H + A acido base coniugata In generale, in soluzione acquosa si ha : H3O+ + A- HA + H2O Es. acido acido c. base c. base CH3COOH + H2O CH3COO– + H3O+ mentre una base è una sostanza che acquista protoni trasformandosi nel suo acido coniugato B + H+ ⇔ BH+ base acido coniugato In generale, in soluzione acquosa si ha : H2 O + B Es. acido base NH3 + H2O BH+ + OHacido c. NH4+ + OH– base c. 1 13/12/2012 Esercizio: Quali delle seguenti molecole possono essere basi di Brønsted? a) H2xO b) HCl c) NH x 3 d) H2SO4 NOTA 1: La definizione di Brønsted non fa riferimento ad un particolare tipo di solvente e si applica anche in caso di solventi diversi dall’acqua o anche in assenza di solvente (reazioni gassose). Es. HCl(g)+ NH3(g) NH4+ + Cl- (= NH4Cl(s) ) NOTA 2: Lo ione H+, che ha dimensioni piccolissime, in soluzione acquosa non esiste come tale, ma nella forma idratata di ione H3O+, ione idronio (o idrossonio, o ossonio). HCl aq → H+ + Cl– HCl + H2O → H3O+ + Cl– L'autoionizzazione dell'acqua H3O+ + OH– H2 O + H2 O acido 1 base 2 acido 2 base 1 Anche se in misura molto piccola, questa reazione tra molecole d’acqua, detta di autoionizzazione, decorre veramente [H3O+][OH–] K = ———————— [H2O]2 K·[H2O]2 = Kw = [H3O+][OH–] Kw : costante del prodotto ionico dell'acqua o prodotto ionico dell'acqua a 25 °C: Kw = [H3O+][OH–] = [OH–]2 = [H3O+]2 = 10 –14 [OH–] = [H3O+] = Soluzione neutra Soluzione acida Soluzione basica 10–14 = 10–7 M [H3O+] = [OH–] [H3O+] > [OH–] [H3O+] < [OH–] 2 13/12/2012 pH, pOH, pK pH = –log [H3O+] pH il logaritmo della concentrazione molare degli ioni idrogeno presenti in tale soluzione cambiato di segno p ≡ –log pOH = –log [OH–] pK = –log K Per soluzioni acquose a 25°C Kw = [H3O+][OH–] = 10–14 pKw= 14 pH + pOH = -log[H3O+] - log[OH-] = -log [H3O+][OH–] = pkw = 14 pH = 14 - pOH pH<7 soluzione acida ; pH > 7 soluzione basica Esempio: Calcolare [OH-] in una soluzione acquosa in cui [H3O+] = 4.52 × 10-3 M [OH-] = Kw/[H3O+] = 2.21 x 10-12 Il pH di soluzioni di acidi forti, o di basi forti diluiti Grado di ionizzazione (α) di un acido α ≅1 α ≅1 3 13/12/2012 Il pH di soluzioni di acidi forti, o di basi forti diluiti pH di una soluzione di HA 0,1 M HA + H2O → H3O+ + A– [H3O+] = [HA] perché è completamente dissociato pH = –log [H3O+]= –log [HA] = 1 per soluzioni di acidi forti monoprotici la concentrazione degli ioni idrogeno è pari alla concentrazione molare dell’acido stesso pH, di una soluzione di BOH 0,1 M H2O B(OH) → OH- + B+ [OH-] = [B(OH)] pOH = –log [OH-] = –log [B(OH)] = 1 pH = 14 – pOH = 13 per soluzioni di basi forti monoidrossiliche la concentrazione degli ioni idrossile è pari alla concentrazione molare della base stessa ESERCIZIO 1 Calcolare il pH e la concentrazione delle specie ioniche in una soluzione 8,62·10-1 M dell’acido forte HClO4. HClO4 + H2O → H3O+ + ClO4 – 8,62·10-1 mol HClO4= mol H3O+ = mol ClO4 – [H3O+] = [ClO4 – ] = 8,62·10-1M pH = –log [H3O+]= –log (8,62·10-1M) = 0,06 R = [pH = 0.06] ESERCIZIO 2 Calcolare il pH e la concentrazione delle specie ioniche in una soluzione 4,44·10-2 M della base forte NaOH. -2 H2O NaOH → Na+ + OH- pOH = -log[OH ] = - log 4,44·10 M = 1.353 pH = 14 - pOH = 14 - 1.353 = 12.6 R = [pH = 12,6] ESERCIZIO 3 Calcolare il pH per la soluzione in cui vi sono 14,0 mg di NaOH in 250 mL di soluzione 0.014 g/40 g/mol = 3.5 x 10-4 mol [OH-] = 3.5 x 10-4mol/0.250 L = 1.4 x 10-3 M pOH = -log [OH-] = 2.85 pH = 14 – pOH = 11.15 R = [pH = 11.15] 4 13/12/2012 ESERCIZIO 4 Calcolare il pH per una soluzione di Ba(OH)2 1 × 10-3 M Ba(OH)2 → Ba2+ + 2OH – Ogni mole di Ba(OH)2 si dissocia producendo due moli di OH-. Quindi: [OH-] = 2 x 10-3 M pOH = -log [OH-] = 2.7 pH = 14-pOH = 11.3 R = [pH = 11.3] ESERCIZIO 5 Calcolare il pH per una soluzione di HCl 1 × 10-8 M HCl + H2O → H3O+ + Cl – Data l’elevata diluizione di HCl, il contributo dell’autoionizzazione dell’H2O non è trascurabile. La concentrazione totale di ioni H3O+ sarà quindi, approssimativamente: [H3O+] = (1 x 10-7 + 1 x 10-8) M = 1.1 x 10-7 M pH = -log[H3O+] = 6.96 R = [pH = 6.96] Il pH di soluzioni di acidi deboli o di basi deboli Calcolare il pH, di una soluzione di HA CA = concentrazione molare iniziale dell’acido [A–][H3O+] Ka = ——————— [HA] HA + H2O → H3O+ + A– AH H2O A- H3O+ Inizio cA - 0 0 Variazione -x - +x +x Eq. cA- x - x x [A–][H3O+] [x][x] [x][x] Ka = ——————— = ——————— ≅———— [HA] [CA-x] CA pH= - log Medesimo Ragionamento per le basi deboli pOH= - log KBCB KACA pH=14-pOH 5 13/12/2012 ESERCIZIO 6 Calcolare il pH in una soluzione 1,00 M di acido acetico CH3COOH sapendo che la sua costante di dissociazione è Ka= 1,85·10–5. CH3COO– + H3O+ CH3COOH + H2O Ka = [CH3COO–][H3O+] ———————— [CH3COOH] [H3O+]2 Ka ≅ —————— [CH3COOH] [H3O+] ≅ (Ka·Ca)1/2 = 1,85·10–5 [H3O+]2 ≅ ———— Ca [H3O+] ≅ 1,85·10–5· 1,00 = 0,00430 M pH = –log [H3O+]= –log (4,3·10-3 M) = 2,37 R = [pH = 2.37] ESERCIZIO 7 Calcolare il pH di una soluzione 0.1 M di NH3 in acqua, sapendo che la sua costante di dissociazione basica vale Kb= 1.8 x 10-5 M. [NH3] [NH4+] Kb = [NH4+][OH-] [NH3] [OH-] Ciniziale 0 +x 0 +x Cfinale 0.10 M-x x x 0.10 M Trasformazione -x x= (0.10 M x (1.8 x10-5))1/2 x = 1.34 x 10-3 M (effettivamente trascurabile rispetto alla CB) pOH = -log[OH-] = -log(1.34 x 10-3) = 2.87 pH = 14-pOH = 11.13 [pH = 11.13] 6 13/12/2012 ESERCIZIO 8 L’ammoniaca è una base debole con Kb= 1,79·10–5. Calcolare quale concentrazione deve avere una soluzione di ammoniaca perché il suo pH sia 11,040. [OH ] = − K bC b pOH = 14-pH = 14-11.040 = 2.96 [OH-] = 1.096 x 10-3 M Cb = [OH-]2/Kb = 6.7 x 10-2 M [Cb ≅ 6,7 ·10-2 M] ESERCIZIO 9 Calcolare il pH a 25°C di una soluzione acquosa di 0.1 M di H2SO4 sapendo che: pKa2= 1.92 M H2SO4(aq)+ H2O HSO4-(aq) )+ H2O HSO4- Conc. Iniz. Ka2 = x (0.1M + x) H3O+(aq) + SO42-(aq) H 3 O+ SO42- 0.1 M 0.1 M 0 -x +x +x Modificazione Conc. all’eq. H3O+(aq) + HSO4-(aq) 0.1 -x pKa2= 1.92 M 0.1 + x x Ka2= 10-1.92 = 0.012 M (0.1M - x) x2 + (0.112 M)x – 0.0012 M = 0 x1= 0.010 M x2= -0.122 M x1 è l’unico valore che ha significato fisico pH = -log 0.110 = 0.96 [pH = 0.96] 7 13/12/2012 L'idrolisi dei sali un sale deve essere pensato come il prodotto della reazione tra un acido e una base più un acido è forte, più la sua base coniugata è debole (e viceversa) idrolisi del sale costituito da un acido debole e da una base forte A- + BA + H2O A– + H2O AH + B+ + H2O B+ Soluzione BASICA Base coniugata di acido debole OH– Acido coniugato di base forte BOH + H+ idrolisi del sale costituito da un acido forte e da una base debole A- + BA + H2O A– + H2O AH + B+ + H2O B+ Soluzione ACIDA Base coniugata di acido forte OH– Acido coniugato di base debole BOH + H+ Quantitativamente … costante di idrolisi basica Kib A– + H2O HA + OH– [HA][OH–] Kib = ————— [A–] la costante di idrolisi, Ki, ha un valore facilmente calcolabile dalla costante di dissociazione dell'acido stesso o della base stessa coinvolti nella reazione di idrolisi [HA][OH–] Kib = ————— [A–] Kw Kib = —— Ka [HA][OH–][H3O+] = ———————— [A–][H3O+] [HA]·Kw = ————— [A–][H3O+] Kw = —— Ka tanto più debole è l'acido da cui deriva il sale tanto più elevata è la costante di idrolisi basica costante di idrolisi acida Kia B+ + H2O Kw Kia = —— Kb BOH + H+ tanto più debole è la base da cui deriva il sale tanto più elevata è la costante di idrolisi acida 8 13/12/2012 • se la base da cui si può pensare originato il sale è tanto forte quanto è forte l'acido da cui si può pensare originato il sale (ovvero, se Ka = Kb) la soluzione risultante è neutra • se la base è più debole di quanto debole è l'acido (ovvero, se Ka > Kb) la costante di idrolisi del catione, Ki = Kw/Kb, è maggiore della costante di idrolisi dell'anione, Ki = Kw/Ka Ciò significa che la produzione di ioni H3O+ dall'idrolisi del catione supera la produzione di ioni OH– dall'idrolisi dell'anione e la soluzione risultante è acida • se la base è meno debole dell'acido (ovvero, se Ka < Kb) significa che la produzione di ioni H3O+ dall'idrolisi del catione è inferiore alla produzione di ioni OH– dall'idrolisi dell'anione, per cui la soluzione risultante è basica ESERCIZIO 10 Calcolare il pH di una soluzione 0.15 M di CH3COONa(aq), sapendo che la Ka dell’acido acetico (CH3COOH) è 1.8 x 10-5 M. CH3COONa CH3COO- + H2O CH3COO- + Na+ CH3COOH + OH- Kb = Kw/Ka= 5.56 x 10-10 M = x2/(0.15 M-x)= x2/(0.15M) x = (Kb Cb)1/2= 9.1 x 10-6 M pOH = -log(9.1 x 10-6) = 5.04 pH = 14-5.04 = 8.96 [pH = 8.96] 9 13/12/2012 ESERCIZIO 11 Calcolare il pH in una soluzione 2,42·10–1 M di cloruro di ammonio sapendo che la costante di dissociazione dell’ammoniaca è Kb= 1,79·10-5. NH4+ + Cl- NH4Cl NH4+ + H2O NH3 + H3O+ Kw 1·10–14 Ka = —— = —————— = 5,59·10–10 Kb 1,79·10–5 [H3O+] ≅ Cb·Ka = 2,42·10–1 M · 5,59·10–10 = 1,163·10–5 M pH = –log [H3O+]= –log (1,163·10–5 M ) = 4,93 Prodotto di Solubilità (equilibri eterogenei) Soluzione SATURA Ba2+ + SO42- BaSO4(s) Solubilità = 1,04 105 M Solubilità = 2.43 mg/L Soluzione SATURA K = KPS = [Ba2+][SO42-] Prodotto di solubilità dipendente da T. Permette di valutare l’effetto dello ione in comune In generale AnBn nAm+ + mBn- KPS = [Am+]n [Bn-]m 10 13/12/2012 La solubilità di un composto può essere ricavata dal Kps. ESEMPIO. Ca2+(aq) + 2 F-(aq) CaF2(s) Posto che la [Ca2+] = S e la [F-] = a 2S e la Kps = 4.0 x 10-11 Allora Kps= S(2S)2 = 4S3 Da cui S = 2,15 x 10-4 M ESERCIZIO 12 Calcolare la solubilità in mol/L di SrF2 e SrSO4 sapendo che i prodotti di solubilità valgono KPS(SrSO4) = 3.8 10-7 KPS(SrF2) = 2.8 10-9 [6.2 x 10-4 mol/L ; 8.9 x 10-4 mol/L ] Effetto dello ione in comune Quando un sale solubile viene aggiunto ad una soluzione acquosa di un sale poco solubile con il quale ha uno ione in comune, la solubilità del sale poco solubile diminuisce in maniera considerevole Es. AgCl(s) Ag+(aq) + Cl-(aq) Kps = [Ag]+[Cl-]= 1.6 x 10-10 M S = Kps1/2 = 1.3 x 10-5 M Se a questa soluzione aggiungiamo NaCl, la concentrazione degli ioni Cl- aumenta. Per mantenere inalterato il Kps, la concentrazione degli ioni Ag+ deve diminuire, quindi si osserva la precipitazione di AgCl. La solubilità di AgCl in queste condizioni risulta pertanto molto minore rispetto a quella di AgCl in acqua pura. [Ag+] = Kps / [Cl-] [Ag+ ] in una soluzione contenente NaCl 0.1 M è = a 1.6 x 10-9 M, cioè di un ordine di grandezza inferiore rispetto a quella di AgCl in H2O pura. 11 13/12/2012 ESERCIZIO 13 “Effetto dello ione in comune” Calcolare quanti grammi di PbCrO4 si possono sciogliere in: a) 1 Litro di H2O b) 1 Litro di soluzione acquosa 0,100 M di Na2CrO4 Kps PbCrO4 = 1.77 x 10-14 Kps= [Pb2+][CrO42-] = 1.77 x 10-14 [Pb2+] = [CrO42-] = 1.33 x 10 g sciolti in 1 L H2O pura = 1.33 x 10 -7 -7 M mol x 323.18 g/mol = 4.3 x 10-5 g Kps= [Pb2+][CrO42-] x 0.1 + x ≈ 0.1 da cui x = 1.77 x 10-13 M 5.72 x 10-11 g sciolti in 1 L si soluzione acquosa 0.1 M Na2CrO4 [4,30 10-5 g ; 5,72 10-11 g ] 12
Scarica