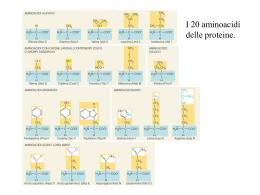
INTRODUZIONE ALLA BIOCHIMICA 1 LE PROTEINE SONO LE MACROMOLECOLE BIOLOGICHE PIU’ ABBONDANTI PRESENTI IN TUTTI I TIPI DI CELLULE E IN TUTTE LE FRAZIONI SUBCELLULARI E SVOLGONO UN NUMERO ENORME DI FUNZIONI NEL NOSTRO ORGANISMO SONO PRESENTI MIGLIAIA DI TIPI DIVERSI DI PROTEINE: CIASCUNA DI LORO E’ COSTITUITA DA UNITA’ MONOMERICHE CHIAMATE AMINOACIDI. ESISTONO 20 TIPI DIVERSI DI AMINOACIDI, TUTTI ACCUMUNATI DALL’AVERE LA SEGUENTE STRUTTURA: Gruppo R Gruppo amminico Gruppo carbossilico 2 IL GRUPPO R E’ QUINDI LA PARTE DELLA MOLECOLA CHE DIFFERENZIA TRA LORO I VARI AMINOACIDI R GRUPPO R CARICO NEGATIVAMENTE GRUPPO R ALIFATICO, NON POLARE GRUPPO R ATOMATICO GRUPPO R POLARE, NON CARICO GRUPPO R CARICO POSITIVAMENTE 3 R polare, non carico R aromatico R carico positivamente R alifatico, non polare R carico negativamente 4 COME SI LEGANO TRA LORO DUE ( O PIU’ ) AMINOACIDI? CON IL LEGAME PEPTIDICO E’ UN LEGAME IN CUI SI HA ELIMINAZIONE DI UNA MOLECOLA D’ACQUA LA CATENA PUO’ ALLUNGARSI AD ENTRAMBI LE ESTREMITA’. LE PROTEINE POSSONO CONTENERE MIGLIAIA DI UNITA’ MONOMERICHE 5 MOLTE PROTEINE CONTENGONO OLTRE AGLI AMMINOACIDI, ALTRI GRUPPI CHIMICI: SI CHIAMANO PROTEINE CONIUGATE E LA PARTE NON AMMINOACIDICA DELLA PROTEINA SI DEFINISCE GRUPPO PROSTETICO IL GRUPPO EME CONTIENE MOLECOLE AROMATICHE E UN ATOMO DI FE L’ATOMO DI FE NEL SUO STATO DI OX +2 E’ IN GRADO DI LEGARE L’OSSIGENO EMOGLOBINA 6 LE PROTEINE SONO MOLECOLE MOLTO COMPLESSE, MOLTO NUMEROSE NELLE CELLULE E MOLTO DIVERSE LE UNE DALLE ALTRE. QUANDO BISOGNA STUDIARLE, LA LORO STRUTTURA COMPLESSA VIENE COME “SMONTATA” IN QUATTRO LIVELLI DI COMPLESSITA’: LA SERIE DEGLI AMINOACIDI COSTITUISCE LA STRUTTURA PRIMARIA DELLA PROTEINA 7 α elica β foglietto LE CATENE DI AMINOACIDI SI ORGANIZZANO NELLO SPAZIO IN DUE MODI PRINCIPALI:α ELICA E β FOGLIETTO. A FAR RIPIEGARE LA CATENA IN UN MODO O NELL’ALTRO SONO LEGAMI H CHE SI FORMANO TRA AMINOACIDI NON DIRETTAMENTE LEGATI DAL LEGAME PEPTIDICO 8 α ELICA LE STRUTTURE α ELICA O β FOGLIETTO RAPPRESENTANO LA STRUTTURA SECONDARIA DI UNA PROTEINA β FOGLIETTO 9 LA STRUTTURA TERZIARIA DI UNA PROTEINA E’ DEFINITA DALLA DISPOSIZIONE NELLO SPAZIO DI TUTTI GLI ATOMI CHE COMPONGONO LA MACROMOLECOLA POSSIAMO AVERE PROTEINE FIBROSE O GLOBULARI 10 LE PROTEINE FIBROSE SONO ADATTE A RUOLI STRUTTURALI IL COLLAGENO E’ PRESENTE NEL TESSUTO CONNETTIVO ( TENDINI, CARTILAGINI, MATRICE ORGANICA DELLE OSSA ). LA CHERATINA HA STRUTTURA SIMILE 11 UNA PROTEINA GLOBULARE SEMPLICE E’ LA MIOGLOBINA, UNA PROTEINA MUSCOLARE CHE LEGA L’OSSIGENO E’ UNA MOLECOLA PARTICOLARMENTE ABBONDANTE NEI MUSCOLI DEI MAMMIFERI MARINI SONO PROTEINE GLOBULARI GLI ENZIMI, LE PROTEINE DI TRASPORTO, LE PROTEINE REGOLATRICI, LE IMMUNOGLOBULINE… 12 MOLTE PROTEINE SONO FORMATE DA PIU’ SUBUNITA’ POLIPEPTIDICHE ( DA DUE A CENTINAIA ). LA STRUTTURA QUATERNARIA DESCRIVE APPUNTO IL MODO IN CUI QUESTE SUBUNITA’ SI LEGANO. Una delle 4 subunità Gruppo eme STRUTTURA QUATERNARIA DELL’EMOGLOBINA 13 PER RICAPITOLARE…. 14 IN AMBIENTI DIVERSI DA QUELLI “STANDARD” NEI QUALI LE PROTEINE SI SONO EVOLUTE, QUESTE MOLECOLE POSSONO ANDARE INCONTRO A VARIAZIONI STRUTTURALI. A CAUSARE QUESTO CAMBIAMENTO NELLA STRUTTURA DELLA MOLECOLA ( DENATURAZIONE ) POSSONO ESSERE CONTATTO CON SOLVENTI ORGANICI, DETERGENTI VARIAZIONI DI T VARIAZIONI DI pH LA DENATURAZIONE E’ UN PROCESSO REVERSIBILE 15 SIMULAZIONE DEL PROCESSO DI RIPIEGAMENTO DI UN POLIPEPTIDE 16
Scaricare