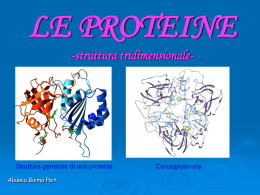
PROTEINE Funzioni, struttura e caratteristiche 1 FUNZIONI • Catalisi enzimatica • Trasporto • Deposito e protezione • Funzione strutturale • Contrazione • Pompe e canali ionici • Regolazione genica • Ormoni e fattori di crescita 2 3 4 5 6 Nelle proteine si riconoscono quattro diversi livelli di struttura, primaria, secondaria, terziaria e in qualche caso , quaternaria La struttura primaria di una proteina è data dalla sequenza degli aminoacidi che la compongono Questa a sua volta è specificata dalla sequenza di nucleotidi del DNA del gene che specifica quella proteina A causa dei molteplici legami deboli (legami idrogeno) che si formano tra i residui aminoacidici, non appena sono assemblati gli aminoacidi non rimangono allineati ma le catene si ripiegano in modo ordinato ( struttura secondaria) Esistono due modi principali per ripiegarsi: - α Elica - Foglietto β (foglietto pieghettato) Il fatto che una certa porzione dalla catena polipeptidica assuma l’una o l’altra struttura secondaria dipende da quali sono i residui aminoacidici e di coseguenza da quali legami deboli si instaurano 7 Proteine Sequenza –C-C-N- α Elica Foglietto β 8 Proteine 9 Struttura terziaria α Elica Foglietto β Nella maggior parte delle proteine le catene di aminoacidi (siano esse organizzati ad α Elica che Foglietto β) si ripiegano a gomito dando così alla proteina una una forma globulare Il ripiegamento è causato: 1) Dalla formazione di legami deboli (legami idrogeno) 2) Dalla tendenza dei diversi residui aminoacidici a portarsi verso l’esterno (ambiente polare) o verso l’esterno (ambiente apolare) 3) Dalla formazione di legami covalenti In particolare tra due molecole dell’aminoacido cisteina si può formare un ponte disolfuro 10 Proteine Alcune proteine mostrano struttura quaternaria in quanto sono composte da più sub-unità distinte e legate tra loro Ad esempio l’emoglobina, la proteina che trasporta l’ossigeno nel sangue, è composta di quattro sub-unità proteiche simili tra loro. Ogni unità contiene un gruppo eme, una molecola non-proteica che contiene Ferro, il quale si lega con l’O2 trasportandolo dai polmoni ai tessuti. Le molecole non proteiche che si legano ad una proteina prendono il nome di gruppo prostetico . Un altro gruppo prostetico è il retinale (che abbiamo visto 11 deriva dal β-carotene) e che si combina con la proteina OpsinaProteine Denaturazione e rinaturazione Il fatto che una data proteina assuma una determinata struttura secondaria e terziaria è determinato in modo automatico dalla sua struttura primaria Esso è dovuto al formarsi di una quantità di legami deboli e attrazione tra le molecole nonché alla tendenza di certi residui aminoacidici di portarsi all’esterno della molecola (quelli idrofili) o all’interno (idrofobici) o verso porzioni della stessa proteina cariche positivamente o negativamente. Se tuttavia mettiamo la proteina in un altro solvente (es. apolare) oppure ad un pH o una temperatura molto diversi da quelli nei quali si trovano abitualmente, la proteina cambia forma e perde le sue proprietà (denaturazione) In qualche caso si può ritornare allo stato originairio ripristinando le condizioni primitive (rinaturazione) ma per lo più avvengono cambiamenti irreversibili che non lo permettono 12 Proteine Metodi di separazione delle proteine in base alle loro proprietà acido-base • elettroforesi • Western blotting • Cromatografia a scambio ionico 13 Precipitazione con mezzi chimici •Acidi minerali forti •Reattivi degli alcaloidi •Sali di metalli pesanti •Sali dei metalli alcalini o alcalini-terrosi •alcool 14 Flusso dell’ informazione genica 15 Sintesi delle proteine Trascrizione l’istruzione viene ricopiata in RNA 1- trascrizione amminoacidi ribosoma Nucleotidi RNA Lettura L’mRNA viene portato ai ribosomi proteina 2- trasduzione Trasduzione Gli enzimi portano ai ribosomi i tRNA con tripletta complementare (anticodone) a ogni tripletta (codone) dell’mRNA Sintesi del polipeptide Ogni tRNA porta un amminoacido particolare a seconda dell’anticodone 16
Scaricare