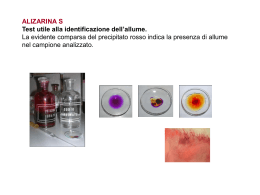
Assassinio all’aeroporto – Risposte Ecco le 5 risposte per ognuna delle 4 proteine sospette Le domande: 1. Di che proteina si tratta? 2. Da che organismo proviene? 3. Quale è la sua funzione? 4. Questa proteina può essere la proteina incriminata? Potrebbe essere la responsabile della morte del turista? Perchè sì? Perché no? 5. Questa proteina ha altre caratteristiche, rilevanti per l’indagine? P.sospetta1 1. alfa‐1‐caseina bovina. Questa sequenza corrisponde agli amino acidi 16‐214 della proteina (gli amino acidi 1‐15 sono il peptide segnale). Questa, insieme alla lattoglobulina, è la principale proteina del latte. Viene secreta nel latte. 2. Bos Taurus (bue/mucca). 3. Ha un importante ruolo nella capacità del latte di trasportare il fosfato di calcio. 4. La proteina non è sospetta. E’ una proteina naturale del latte. 5. Nessuna caratteristica rilevante per le indagini. P.sospetta2 1. Questa proteina è il precursore della beta‐lactoglobulina della mucca, la principale proteina del latte. Amino acidi 17‐178 (1‐16 è il peptide segnale). 2. Bos Taurus (bue/mucca) 3. Componente primario del siero del latte, lega il retinolo ed è probabilmente coinvolta nel trasporto di questa molecola. Proteina tessuto specifica. Sintetizzata dalla ghiandola mammaria e secreta nel latte. 4. La proteina non è sospetta. 5. Allergene. Nell’uomo provoca reazioni allergiche ed è una delle cause dell’intolleranza al latte bovino. P.sospetta3 1. Metalloproteinasi emorragica (EC 3.4.24.42) (Atrolysin D/C). Emorragico significa che causa emorragie e quindi sanguinamenti. 2. Crotalus atrox (serpente a sonagli, crotalo adamantino occidentale). 3. L’Atrolisina è una metalloproteinasi ed è la tossina di un serpente a sonagli molto velenoso. Le metalloproteinasi sono enzimi che rompono i legami peptidici; la loro attività dipende dalla presenza, come cofattore, di uno ione metallico: lo zinco. Questa classe di enzimi viene prodotta dalle cellule epiteliali, dai fibroblasti e dalle cellule infiammatorie e porta alla distruzione delle membrane basali dell’epitelio. 4. L’enzima è molto sospetto, perché causa emorragie interne. E’ una tossina molto potente, un veleno. 5. Zinco ‐ proteasi. La sequenza nella banca dati è molto più lunga. Gli amino acidi 191‐393 costituiscono il dominio funzionale dell’enzima. P.sospetta4 1. Albumina umana. 2. Homo sapiens. 3. L’albumina è la principale proteina del plasma, lega acqua, ioni Ca(2+), Na(+), K(+), acidi grassi, ormoni, bilirubina e farmaci. La sua funzione più importante è la regolazione della pressione osmotica del sangue. 4. La proteina non è sospetta. 5. Nessuna caratteristica rilevante per le indagini. Conclusione finale La vittima è deceduta per un morso di un serpente a sonagli. Exercise 8: 6 amino acidi sono diversi, ma di questi 4 sono molto simili. Exercise 9: Ci sono 61 amino acidi non uguali, ma 38 sono molto simili. A causa della differenza in lunghezza fra le due sequenze proteiche, 1 amino acido della proteina sospetta 2 (Serina 150) non ha un residuo corrispondente nel cane. I ponti disolfuro in più sono colorati in giallo, arancio e rosso Come disegnare un farmaco in 3D Esercizio 1 Negli studi mutazionali, vengono sostituiti ad uno ad uno tutti gli amino acidi, in genere con una alanina. Si guarda quali sono le posizioni che, se sostituite, provocano alterazioni funzionali della molecola. La proteina mutata lavora meglio, peggio o allo stesso modo rispetto alla versione normale? La maggior parte delle mutazioni hanno effetti poco rilevanti o non ne hanno alcuno. Le mutazioni di residui importanti hanno effetti drastici sulla funzione: generalmente, quando si sostituisce un residuo cruciale, la proteina perde completamente la sua funzione. Esercizio 2 Esercizio 3 Quali sono gli atomi che puoi trovare nelle proteine? 1. Gli atomi presenti negli amino acidi sono carbonio idrogeno ossigeno azoto e zolfo. 2. In Yasara gli atomi hanno questo codice/colore: * Rosso: ossigeno * Blu scuro: azoto * Verde: zolfo * Azzurro: carbonio Esercizio 4 In questa rappresentazione, i legami covalenti si vedono come bastoncini di un colore specifico. Quale è la differenza fra i legami gialli e quelli bianchi in questa lista di aminoacidi? Legami bianchi: legami singoli covalenti Legami gialli: legami doppi covalenti Esercizio 5 1. A quale tipo di interazione corrisponde ciascun colore? 2. Localizza queste interazioni nella rappresentazione 2‐D del peptide. * verde: legami idrogeno * blu: interazioni ioniche / ponti salini * arancione: interazioni idrofobiche Esercizio 6 Vedi esercizio 2 Esercizio 7 Con i tasti F5, F6 e F7 si possono facilmente mettere in evidenza gli elementi della struttura secondaria. Quale è la struttura secondaria delle regioni rosse e blu della proteina? rosso: beta ‐filamento (più beta‐filamenti formano il beta‐foglietto) blu: alfa elica Esercizio 8 Trova i seguenti cinque elementi (o strutture): Un atomo di ossigeno con un doppio legame: ball e stick Un legame peptidico: (ball e) stick La catena laterale di una istidina: tutte le rappresentazioni che mostrano le catene laterali Una alfa elica: backbone o cartoon Un ponte disolfuro: stick Esercizio 9 Perchè il sito attivo si trova in cavità della superficie? Perché in una cavità è possibile un maggior numero di interazioni (legami idrogeno, interazioni ioniche, interazioni idrofobiche). Queste interazioni fanno aumentare la specificità dell’interazione con il substrato/ligando. Esercizio 11 Emoglobina: usa il ferro; il citocromo: usa il ferro; la calmodulina usa il calcio. Esercizio 14 Secondo il principio della chiave e serratura l’enzima (la serratura) funziona solo con il ligando (la chiave) giusto. Esercizio 16 La maggior parte degli atomi indicati con la freccia può formare legami idrogeno. Il gruppo ‐SH (grouppo ‐tio) in teoria può formare legami idrogeno, ma sono molto deboli. L’ossigeno carico negativamente nel candidato 2 (C) può formare un legame ionico con lo Zn2+ della proteinasi, mascherandone la carica ed impedendo l’attività catalica dll’enzima. NB: la carica è distribuita sull’intero gruppo carbossilico. Il legame ionico si forma quindi con l’intero gruppo (l’ossigeno carico e l’ossigeno con il doppio legame). Domanda finale Quale antidoto useresti? Il ligando C è il candidato migliore come antidoto. In questo ligando, il legame peptidico forma due legami idrogeno e il gruppo carbossilico forma un ponte salino molto forte con lo ione zinco della proteina. Gli altri ligandi formano meno (o meno forti) legami.
Scaricare