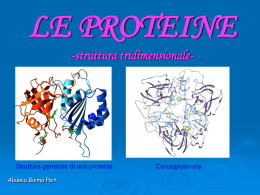
Le proteine : l’importanza nell’etimo PROTEINA PROTE ICO proteiõs protôs acidi nucleici ed carboidrati altro 5% 2% lipidi 10% chimICO PROTE INA sostanza, medicinale primo Sono i costituenti principali del corpo umano proteine 18% acqua 65% Le proteine: prime, importanti … ma quanto grandi? Cosa sono le proteine? Polimero = polys méros molte parti ------ molte parti, ma anche differenti parti? Polietilene: molte parti di etilene (sempre la stessa parte) Poliammide 6: molte parti di caprolattame (lattame di un amminoacido “acido 6ammino-esanoico”) (sempre la stessa parte) . Proteine: molte parti di 20 diverse parti (gli amminoacidi naturali) 20 diverse parti grande versatilità e potenzialità struttura funzione Le proteine sono macromolecole biologiche polimeriche che derivano dall’unione di unità monomeriche: gli amminoacidi I costituenti delle proteine: gli amminoacidi Il carbonio alfa è chirale. L- Gliceraldeide L-amminoacido amminoacidi : proteine = lettere : parole ? mRNA •20 amminoacidi – 21 lettere; •il significato (la funzione) non dipende da quali costituenti si utilizzano ma da come sono disposti; A + M + O + R ROMA MORA RAMO OMAR •il significato cambia sostituendo, togliendo aggiungendo un costituente; R O M A A R O M A M O R A M O DA •hanno un verso di lettura. M O DA ma le proteine sono molto più lunghe e c’è molto di più …………. A D O M Proteine non Parole •Sono sintetizzate nel citoplasma delle cellule sui ribosomi. mRNA •Sanno come organizzarsi e conoscono il loro ruolo. •Le proteine non sono semplici polimeri lineari di amminoacidi ma ogni proteina assume la struttura tridimensionale più adatta alla funzione che svolge in un determinato organismo L’informazione è contenuta nella sequenza di aminoacidi La funzione delle proteine dipende dalla loro struttura •Funzione strutturale: proteine fibrose la cui funzione è quella di sostegno, di protezione, di supporto meccanico (capelli, unghie, tendini, cartilagine ecc.) •Funzione contrattile o motile: le fibre muscolari, le ciglia e i flagelli delle cellule sono proteine •Funzione di regolazione: regolano le attività cellulari e fisiologiche (es. ormoni) •Funzione di trasporto: le proteine trasportatrici svolgono un ruolo fondamentale per la vita delle cellule e degli organismi (es. emoglobina coinvolta nel trasporto di ossigeno ) •Funzione catalitica: tutti gli enzimi, più o meno complessi, sono costituiti da proteine •Funzione di difesa: gli anticorpi e il sistema della coagulazione del sangue sono di natura proteica Sequenza <--> Struttura <--> Funzione La funzione che una proteina svolge è strettamente legata alla struttura tridimensionale che la proteina assume La struttura tridimensionale finale è quella più stabile dal punto di vista termodinamico e viene raggiunta attraverso vari livelli di organizzazione strutturale Tali livelli di organizzazione dipendono dalla sequenza degli amminoacidi che è geneticamente determinata. I livelli di organizzazione Le proteine, dal momento in cui vengono sintetizzate, passano per 3 stadi o livelli di organizzazione Struttura secondaria foglietto -b Struttura primaria Struttura secondaria a -elica Struttura terziaria Struttura quaternaria Le proteine formate da più subunità presentano un ulteriore livello di organizzazione La struttura primaria delle proteine La STRUTTURA PRIMARIA di una proteina è data dall’esatta sequenza degli amminoacidi. Essa non considera le ramificazioni e le altre interazioni ma le determina definendo, così, la forma e quindi la funzione della proteina stessa. Ma come si legano gli amminoacidi? Il legame peptidico - formazione In vitro: viene eliminata acqua! Si ha una reazione di condensazione. H2 O In vivo il processo è diverso. H2 O Legami peptidici La geometria del legame peptidico Piani e Snodi Le configurazioni e le rotazioni nel legame peptidico La configurazione trans è la più stabile. Rotazione •tra Cα e N ammidico (angolo Φ) •tra Cα e C carbonilico (angolo Ψ) Rotazione libera ma limitata per impedimenti sterici tra i gruppi peptidici e le catene laterali La rotazione comporta ripiegamenti Le ragioni del ripiegamento I piani del legame ammidico, ruotando attraverso lo snodo (Ca), consentono il ripiegamento della proteina e quindi il conseguimento di una nuova conformazione. Il processo è spontaneo quindi: DG<0. Ciò significa che ruotando le molecole conseguono una conformazione a minor contenuto energetico e quindi più stabile. ΔG = ΔH – T ΔS Nel caso delle proteine l’energia libera diminuisce perché il processo di ripiegamento è favorito entalpicamente. L’importanza del legame ad idrogeno in biochimica I piani ruotano e … … ruotando gruppi N-H e C=O di due differenti legami peptidici si avvicinano finché … si forma il legame ad idrogeno DH< 0 … e la macromolecola acquisisce una struttura più stabile che determina … DG diminuisce Il processo è spontaneo e … … la struttura secondaria maggiore stabilità legami ad H ripiegamento rotazione Le strutture secondarie quante 2 (principali) quali a-elica; foglietto-b perché (l’una o l’altra) il gruppo R La struttura ad a-elica Il legame ad H (intracatena) si stabilisce tra l’ N-H di un amminoacido e il C=O di quello che lo segue di 4 unità 4 3 2 1 L’elica è destrorsa; ogni giro comprende mediamente 3.6 residui amminoacidici. Tra due Ca successivi distanza : 5 Å; rotazione: 100 gradi La struttura a foglietto b Catene polipeptidiche quasi completamente estese 3,5Å distanza assiale tra due amminoacidi adiacenti I gruppi R sporgono alternativamente al di sopra e al di sotto del piano Legami intracatena (tra due gruppi ripiegati della stessa catena) Il foglietto è costituito da più segmenti che possono avere verso uguale o opposto 7A° Il foglietto b parallelo Il foglietto b antiparallelo Il foglietto b parallelo e antiparallelo I foglietti β delle proteine contengono da 2 a 12 segmenti, in media 6. I foglietti β paralleli con più di 5 segmenti sono rari, perché meno stabili dei foglietti β antiparalleli, in quanto i legami H dei primi sono maggiormente distorti di quelli dei secondi. Si incontrano frequentemente foglietti β contenenti sia segmenti paralleli che segmenti antiparalleli. Foglietto β antiparallelo Foglietto β parallelo Strutture terziaria La catena polipetidica, pur sempre flessibile nonostante la sua struttura secondaria, si ripiega ulterioremente assumendo una forma peculiale nella sua struttura terziaria . α -Elica Foglietto β La struttura tridimensionale è strettamente legata alla funzione che la proteina espleta. La tendenza a ripiegarsi ulteriormente esprime la naturale tendenza a conseguire una conformazione a maggiore stabilità. maggiore stabilità DG<0 interazioni Struttura terziaria: tipi di interazione Legami H Ponti disolfuro Van der Waals Idratazione Ponti salini LA STRUTTURA TERZIARIA DIPENDE DALLA STRUTTURA PRIMARIA Fattori che determinano la struttura della proteina: l’ambiente DNA RNA SEQUENZA STRUTTURA FUNZIONE … ma la conformazione della molecola dipende anche dall’ambiente in cui si trova. Ad esempio in ambiente acquoso e proteine si assestano disponendo i residui polari verso l’esterno e quelli apolari verso l’interno in modo da favorire la loro sospensione in acqua Mentre quelle operanti in ambiente lipofilo, come quello caratteristico delle membrane cellulari, avranno i residui apolari verso l’esterno. Struttura quaternaria Interazione di più proteine attraverso legami deboli. Si forma così un aggregato molecolare nel quale ciascuna proteina costituente (subunità) mantiene la propria struttura terziaria. L’aggregazione di questi monomeri proteici è data essenzialmente dall’effetto idrofobico: quando catene polipeptidiche separate si avvolgono in forme tridimensionali compatte per esporre i gruppi polari verso l’ambiente acquoso e per schermare quelli non polari dall’acqua, allora appaiono sulla superficie delle toppe idrofobiche, in contatto con l’acqua. Queste toppe possono essere schermate dall’ambiente acquoso, se due o più monomeri si assemblano ponendo a contatto le toppe idrofobiche. Struttura quaternaria dell’emoglobina Fe++ d2sp3 Denaturazione STRUTTURA FUNZIONE CONFORMAZIONE TRIDIMENSIONALE NATIVA CONDIZIONI OTTIMALI La conformazione nativa può essere sconvolta e disorganizzata, senza rottura di alcun legame peptidico ma distruggendo solo i legami non covalenti (ponti H, legami ionici, legami idrofobici) DENATURAZIONE: passaggio dalla configurazione nativa (ordinata, funzionale) ad una denaturata (disordinata, non funzionale o meno efficace ed efficiente con riferimento all’attività biologica). Detto passaggio è causato da agenti denaturanti tra i quali i più comuni sono il calore, il pH, i detergenti, e reagenti capaci di dare forti legami H Gli agenti denaturanti IL CALORE: l’energia fornita sotto forma di calore rompe i legami più deboli (intorno a 60°C quasi tutte le proteine sono denaturate). Applicazione: sterilizzazione si uccidono i microbi denaturando le loro proteine in particolare quelle enzimatiche. IL pH (valori estremi): gli acidi e le basi interferiscono con i residui ionizzabili rompendo i legami ionici. Applicazione: il processo di defacazione nelle determinazioni analitiche si allontana la parte proteica precipitandola con un forte acido organico (ad es. acido trifluoroacetico). DETERGENTI: modificano la struttura proteica che rivolge i suoi residui polari verso l’esterno per poter rimanere in sospensione. Applicazione: SDS PAGE REAGENTI capaci di dare forti LEGAMI H: competono con i ponti a idrogeno della struttura secondaria e terziaria della proteina ( es. Urea 8M).
Scaricare