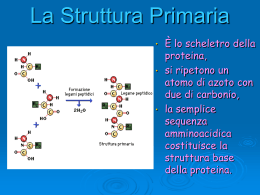
LE PROTEINE -struttura tridimensionale- Struttura generale di una proteina Alessia Baima Peit Ceruloplasmina Cosa sono??? • Sono biopolimeri con forme ben definite. • composti da molteplici amminoacidi, • legati con legami peptidici fra loro. Protein folding Principali funzioni • Hanno molte funzioni fisiologiche: • enzimatica, • di trasporto(di ossigeno, metalli), • recettoriale, • strutturale. Si trovano nei cibi di origine animale: carne, pesce, uova, latte, formaggi, yogurt. di origine vegetale: cereali, legumi, frutta secca. Nel corpo umano: Ogni cellula e tessuto contiene proteine. Ammontano al 20% del peso corporeo complessivo. Struttura È lo scheletro della Primaria proteina, • si ripetono un atomo di azoto con due di carbonio, • la semplice sequenza amminoacidica costituisce la struttura base della proteina. • • Struttura La struttura primaria Primaria di una proteina è una lunga sequenza di amminoacidi legati per mezzo del legame peptidico: il gruppo carbossilico di un amminoacido si lega al gruppo amminico di quello adiacente con la liberazione di una molecola d'acqua. Reazione di condensazione Struttura Dalla proteina possiamo Primaria risalire alla struttura a • Sequenza primaria di amminoacidi differenti. seconda: • del tipo di amminoacidi presenti, • dalla quantità di amminoacidi presenti, • della sequenza amminoacidica (ossia da come gli amminoacidi si dispongono). La Struttura Secondaria • Gli angoli e le lunghezze di legame sono ben definite: • Il gruppo ammidico sta su un piano, • L’azoto è ibridato sp2 e il legame peptidico ha un carattere di doppio legame, • Ciascun gruppo amminico è planare Ma non è detto che due gruppi amminici adiacenti siano coplanari (nello stesso piano). La Struttura Secondaria Essenziale per la determinazione della struttura. • È molto facile formare dei legami idrogeno • La catena si avvolge in modo che l’idrogeno di un ammino gruppo si leghi con legame ad idrogeno col carbonile di un altro residuo aa. La Struttura Secondaria • Studi ai raggi X. • Ipotesi di Pauling: la catena polipeptidica si avvolge su se stessa per formare un’ ELICA! • Tenuta rigida da legami ad idrogeno α- elica La Struttura Secondaria • • L' α-elica ha un passo di 5.4 Å e ogni spira dell'elica è costituita da 3.6 residui amminoacidici. L'eccezionale stabilità di questa conformazione dipende dal fatto che tutti gli NH e i C=O dei gruppi peptidici sono impegnati in legami a ponte di idrogeno. L'α-elica è il risultato del ripiegamento probabilmente più "naturale" che una catena peptidica possa assumere. La Struttura Secondaria • L' α-elica presente nelle proteine è quasi sempre destrogira (l'andamento è quello della filettatura di una vite tradizionale). La Struttura Secondaria • Perché è destrogira? • È dovuto al fatto che gli amminoacidi proteici sono tutti nella configurazione "L" e in un'elica sinistrorsa i gruppi laterali R risulterebbero troppo vicini ai gruppi C=O, destabilizzando l'elica. La Struttura Secondaria • Le catene laterali R dei residui amminoacidici sono tutte rivolte verso l'esterno dell'elica. • Procedendo dall’azoto terminale, tutti i gruppi carbonilici sono rivolti verso il basso. • Sono legati con legami ad idrogeno a gruppi N-H che di trovano avanti lungo la catena. La Struttura Secondaria • I legami ad idrogeno sono allineati lungo l’asse maggiore dell’elica. Alfa- elica vista dall’alto La Struttura Secondaria Le catene peptidiche sono affacciate e sono tenute assieme da legami ad idrogeno fra le diverse catene. • Studiando ai raggi X altre strutture si è trovato un sistema ripetitivo diverso. • Con passo di 7 Å. Struttura a foglietto a La Struttura Secondaria • Le catene adiacente possono svilupparsi in direzione opposta. Beta foglietto anti-parallelo La Struttura Secondaria • Le catene adiacente possono svilupparsi nella stessa direzione. Beta – foglietto parallelo La Struttura Secondaria • I gruppi R delle due catene si trovano una volta sopra e una volta sotto il piano. • Possono dare repulsioni. • Quindi la struttura beta si trova in proteine con amminoacidi che presentano R piccoli. La Struttura Secondaria • Le catene laterali di residui adiacenti sono su lati opposti del foglietto. La Struttura Secondaria • La Struttura Terziaria La struttura terziaria è la conformazione tridimensionale assunta da una proteina. • È stabilizzata da legami non covalenti come ponti idrogeno, interazioni idrofobiche tra amminoacidi non polari e legami ionici. È indispensabile per la sua attività biologica. La Struttura Terziaria • Ma anche da legami covalenti, sotto forma di ponti disolfuro fra due cisteine. • Le interazioni che si instaurano a livello tridimensionale coinvolgono amminoacidi non necessariamente vicini nella struttura primaria. • La Struttura Terziaria Include il ripiegamento delle strutture regolari (alfa-elica e beta-foglietto) dando luogo a combinazioni molto stabili (motivi), che si possono trovare ripetute nella stessa proteina. • gli elementi di struttura secondaria si trovano combinati in particolari motivi strutturali. Motivi nei quali la struttura secondaria può disporsi nello spazio. La Struttura Terziaria • I gruppi R dei vari amminoacidi determinano anche loro la struttura della proteina. • E le sue proprietà macroscopiche. La Struttura Terziaria • Quando le interazioni vengono meno, in presenza di elevate temperature, di pH non ottimale o di detergenti, la struttura tridimensionale viene persa, così la proteina va incontro a denaturazione, perdendo la sua attività biologica. la denaturazione a volte è un processo reversibile, e, allontanando l'agente denaturante, la proteina riprende spontaneamente la sua conformazione tridimensionale (che è dettata dalla struttura primaria). Proteine Fibrose e Globulari • Le proteine possono essere divise in due classi: Proteine fibrose Proteine Globulari Le Proteine Fibrose Sono di origine animali, • insolubili in acqua, • Assolvono ruoli strutturali per lo più. • Si dividono in tre categorie: le cheratine i collageni le sete Formano tessuti protettivi Formano tessuti connettivi Come i bozzoli dei bachi da seta Le Proteine Fibrose Cheratine e collageni hanno strutture ad elica, • Le sete hanno struttura foglietto beta • Gruppi apolari e ponti disolfuro tendono a conferire rigidità e insolubilità alle proteine fibrose. Le Proteine Globulari Sono solubili in acqua, • di forma quasi sferica, • Assolvono funzioni biologiche. • Possono essere: • Enzimi • Ormoni • Proteine di trasporto • Proteine di deposito Le Proteine Globulari Contengono amminoacidi con catene polari e carichi, • Sono strutture elicoidali. • Mioglobina, proteina globulare che trasporta l’ossigeno nei muscoli. Le interazioni sono dovute a ponti disolfuro, alla polarità o meno dei gruppi R, e alla capacità di formare legame ad idrogeno. La Struttura Quaternaria • Ogni proteina tende ad assumere una sola struttura terziaria e proteine differenti assumono conformazioni differenti. Talvolta le proteine possono assumere anche una struttura quaternaria. È composta da aggregati di un certo numero di subunità Emoglobina di un adulto La Struttura Quaternaria • L’aggregazione serve ad evitare alle parti apolari della superficie proteica l’esposizione all’ambiente acquoso della cellula. Riepilogo
Scaricare