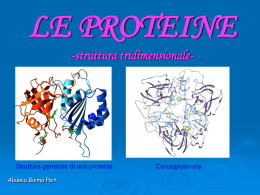
Struttura tridimensionale delle proteine. Strutture: secondaria, terziaria e quaternaria Le molecole proteiche possiedono quattro livelli di organizzazione strutturale: Primaria: la sequenza Secondaria: il ripiegamento locale Terziaria: il ripiegamento complessivo Quaternaria: l’associazione di più catene Struttura primaria • Ogni proteina possiede un ordine definito di residui aminoacidici e questa sequenza è definita come struttura primaria della proteina. • Lys-Lys-Gly-Gly-Leu-Val-Ala-His Struttura secondaria Strutture secondarie • La struttura secondaria di una proteina si riferisce a organizzazioni regolari e ricorrenti nello spazio dei residui aminoacidici adiacenti di una catena polipeptidica. • Strutture secondarie più rappresentate: - a-elica - struttura a foglietto ripiegato (b-struttura o bfoglietto) - b ripiegamento (struttura supersecondaria) • Le strutture secondarie sono stabili in quanto minimizzano le repulsioni steriche e allo stesso tempo rendono massima la potenzialità di formazione dei legami a idrogeno. Struttura secondaria Le possibili conformazioni regolari della catena polipeptidica dovrebbero possedere i seguenti requisiti: 1. Le lunghezze e gli angoli di legame dovrebbero essere distorti il meno possibile rispetto a quelli riscontrati su aminoacidi e piccoli peptidi 2. Due atomi non dovrebbero avvicinarsi tra loro più di quanto sia loro consentito dai rispettivi raggi di van der Waals. 3. Il gruppo amidico dovrebbe rimanere planare e nella configurazione trans. Perciò la rotazione è possibile solo attorno ai due legami adiacenti al carbonio a di ciascun residuo aminoacidico 4. Dovrebbero essere presenti alcuni tipi di legame non covalente per stabilizzare i ripiegamenti regolari. La possibilità più ovvia è costituita dai legami idrogeno tra i protoni ammidici e gli atomi di ossigeno carbonilici: >N — H •••O=C< Strutture secondarie: a-elica • L’ a-elica appartiene alle strutture secondarie più frequenti. • La catena è attorcigliata con un andamento elicoidale destrorso. Ogni giro dell’elica contiene 3.6 residui (passo dell’elica, 0.54nm). • L’a-elica è stabilizzata da legami a ponte di idrogeno tra gruppi --N-H e >C=O di residui distanti l’uno dall’altro 4 posizioni nella sequenza. 3.6 residui 0.54nm a-elica • I gruppi R degli aa si estendono verso l’esterno dell’elica. • A causa di vincoli strutturali non tutti gli aa possono formare l’aelica per vari motivi: Ad esempio per la glicina: R troppo piccola; Per il triptofano: R troppo grande; nel caso della prolina: struttura rigida. Struttura a foglietto ripiegato (b) • Nella struttura a foglietto ripiegato (o b-struttura o foglietto b) la disposizione dei legami peptidici crea una struttura simile ad un foglietto di carta ripiegato in modo regolare. • In questa conformazione si possono formare ponti a idrogeno solo tra catene vicine. • Se le due catene peptidiche hanno direzione opposta la struttura b viene detta antiparallela (a); se le catene hanno la stessa direzione, la struttura b viene detta parallela.(b) • Le catene laterali sono poste sopra e sotto il piano dei legami peptidici. • La struttura b antiparallela ha ponti idrogeno pressoché lineari ed è energicamente favorita. b-struttura Strutture supersecondarie • Sono combinazioni di strutture secondarie ad a-elica e a foglietto b. • I b-ripiegamenti o meandri b si trovano di solito nelle posizioni in cui la catena peptidica cambia bruscamente di direzione. Questi ripiegamenti collegano spesso le estremità di due segmenti adiacenti di un foglietto b ripiegato antiparallelo e comprendono circa 4 residui aminoacidici b-ripiegamento Altre superstrutture secondarie: unità aa tra 2 a-eliche, unità bab un’a-elica tra 2 foglietti b. Struttura terziaria Struttura terziaria • Si riferisce alla relazione spaziale tra tutti gli aminoacidi di una cate= na polipeptidica. • E’ determinata dalla sequenza aminoacidica e tiene conto delle relazioni a lungo raggio esistenti nella sequenza aminoacidica. • In una proteina, quando la catena polipeptidica si avvolge su se stessa, gli aminoacidi che sono localizzati in regioni lontane della sequenza polipeptidica e che fanno parte di strutture secondarie diverse possono ugualmente interagire tra loro. Struttura terziaria Ogni proteina globulare e fibrosa possiede una struttura terziaria caratteristica, composta di elementi di struttura secondaria ( a- eliche, foglietti b, regioni non regolari) ripiegati in modo specifico, per adattarsi al particolare ruolo funzionale che la proteina riveste. Sulla base della struttura terziaria è possibile distinguere due classi di proteine: 1)Globulari 2)Fibrose 1) La maggior parte del lavoro chimico di una cellula, le sintesi, il trasporto e il metabolismo avviene con l'aiuto di una vastissima classe di proteine, le cui catene polipeptidiche sono ripiegate in strutture compatte e molte delle quali contengono gruppi prostetici: proteine globulari. 2) Le proteine fibrose svolgono funzioni strutturali e sono costituite dalla ripetizione di un elemento semplice di struttura secondaria Caratteristiche della struttura terziaria • I modelli di ripiegamento principali sono di due tipi: 1. quelli caratterizzati da un impaccamento di a eliche 1. quelli costruiti su una rete di strutture a foglietto b. I ripiegamenti sono stabilizzati da legami deboli (legami H, interazioni di van der Waals, interazioni carica-carica...) Quando si esamina la localizzazione degli aminoacidi nella struttura tridimensionale, si osserva invariabilmente che i residui idrofobici sono impaccati principalmente all'interno, mentre i residui idrofilici sono sulla superficie, a contatto con il solvente. La struttura terziaria non è rigida: le proteine globulari hanno una certa flessibilità nel loro scheletro e possono andare incontro ad alcune fluttuazioni a breve raggio. Interazioni che stabilizzano la struttura delle proteine • Legami disolfuro (ponti disolfuro): legami covalenti che derivano dall’unione di due gruppi –SH di 2 residui di cisteina con formazione di un residuo di cistina R–S-S-R • Interazioni idrofobiche: tra aa con catene laterali non polari. In ambiente acquoso gli aa apolari tendono a localizzarsi all’interno della molecola proteica; in un ambiente lipidico, quale quello delle membrane, la disposizione è opposta. • Legami a idrogeno: catene laterali contenenti atomi di H legati a O o N possono formare legami ad H con atomi fortemente elettronegativi, es. O di un gruppo carbossilico o carbonilico della stessa catena polipeptidica o con l’ambiente acquoso cellulare. • Interazioni ioniche: I gruppi laterali che recano una carica (positiva –NH3+ o negativa –COO-) possono interagire con gruppi laterali contenenti cariche opposte. Interazioni che stabilizzano la struttura delle proteine (b) Distribuzione dei residui idrofilici e idrofobici nelle proteine globulari. a) Sequenza amminoacidica del citocromo c di cuore bovino. I residui idrofobici (rosso), idrofilici (verde) e anfipatici (bianco) sono molto dispersi nella sequenza. b) Struttura tridimensionale. Sinistra: gli amminoacidi idrofobici si concentrano intorno all’eme e all’interno della molecola. Destra: si notano i residui idrofilici sulla superficie della molecola I domini • Le proteine globulari di grandi dimensioni sono costituite da diversi domini collegati l’uno all’altro da tratti di polipeptide relativamente estesi. • Il dominio è una porzione di catena polipeptidica che si ripiega su se stessa a dare un’unità com= patta che rimane distinta all’interno della strut= tura terziaria dell’intera proteina. Folding delle proteine • Per poter svolgere la propria funzione biologica, una proteina deve essere strutturata nella conformazione nativa. • La conformazione nativa è quella struttura tridimensionale stabile e funzionale, caratterizzata da uno stato a bassa energia e da un’unica e particolare conformazione che consente alla proteina di svolgere correttamente la funzione a cui è deputata. • Folding: processo che, dalla biosintesi del peptide, porta alla proteina strutturata nella forma nativa, biologicamente attiva. • Durante il processo di folding le proteine vanno da uno stato ad alta energia della struttura unfolded ad uno a bassa energia della struttura folded. Denaturazione delle proteine • Le proteine possono perdere la loro organizzazione tridimensionale (struttura nativa) con assunzione di strutture casuali: questo processo viene chiamato denaturazione. • Gli agenti denaturanti possono essere: -calore -pH estremi -solventi organici (alcool o acetone) -soluti (urea) -detergenti. • La perdita della struttura nativa provoca la perdita dell’attività biologica della proteina stessa. Struttura quaternaria delle proteine Struttura quaternaria • Molte proteine esistono nella cellula (in soluzione e in condizioni fisiologiche) come aggregati specifici di due o più catene polipeptidiche ripiegate, o subunità. • Tetramero dell’emoglobina Questa organizzazione quaternaria può essere di due tipi: 1) associazione tra catene polipeptidiche identiche o quasi identiche (omotipica) 1) interazione tra subunità di struttura molto diversa (eterotipica). • In entrambi i casi si ha la formazione di proteine multimeriche. La struttura quaternaria si riferisce alla relazione spaziale tra i polipeptidi o le subunità all’interno di una proteina. Dimero dell’albumina Perché si formano proteine multimeriche? 1. La sintesi di subunità separate può essere più efficiente dell’allungamento notevole di una singola catena polipeptidica e limita la probabilità di introdurre errori durante la sintesi della catena polipeptidica. 1. Nei complessi sopramolecolari la sostituzione di componenti più piccole che si siano usurate o danneggiate può essere effettuata più efficientemente. 1. Le interazioni complesse di più subunità aiutano a regolare la funzione biologica della proteina. PROTEINE MULTIMERICHE: INTERAZIONI OMOTIPICHE PROTEINA-PROTEINA Interazioni tra le catene polipeptidiche ripiegate nelle proteine multimeriche: • ponti salini • legami a idrogeno • interazioni idrofobiche INTERAZIONI ETEROTIPICHE PROTEINA-PROTEINA L'insieme dei tipi di interazione proteinaproteina è molto vasto: sono comuni associazioni specifiche tra molecole proteiche completamente diverse. A volte queste associazioni portano a strutture organizzate che contengono anche più di una decina di subunità diverse. Le interazioni che formano questi complessi sono generalmente forze non covalenti tra superfici proteiche complementari. L'inibitore pancreatico bovino della tripsina forma un complesso stabile con l'enzima tripsina inibendone l'attività proteolitica nel pancreas. Questa simulazione al calcolatore mostra che le due superfici proteiche combaciano perfettamente. Il ripiegamento non corretto delle proteine • Il ripiegamento delle proteine avviene per tentativi e per errori e può produrre delle proteine ripiegate in modo non corretto che in genere vengono degradate dalla cellula. • Non sempre il sistema di controllo funziona, soprattutto durante l’invecchiamento di un individuo provocando un accumulo di proteine non correttamente ripiegate. • Alcune patologie associate a questo fenomeno sono le amiloidosi e le malattie prioniche Amiloidosi (A-B) Alcune proteine apparente mente normali dopo un taglio proteolitico possono formare degli aggregati, con strutture foglietto ripiegato, chiamati amiloidi. (C) L’accumulo di tali strutture può essere tossico per il nostro organismo come nel caso della placca amiloide, generata dall’accumulo della proteina amiloide Aβ derivante dalla proteina precursore dell’amiloide. La placca insieme con i grovigli di neurofibrille (dovuti alla forma anomala della proteina tau) è neurotossica e responsabile del morbo di Alzheimer. Soggetto sano soggetto affetto dal morbo di Alzheimer Nel soggetto affetto dal morbo di Alzheimer il cervello tende a restringersi, si ha degenerazione delle cellule nervose, filamenti dovuti a grovigli di proteine e lesione da accumulo di b-amiloide Malattie prioniche • La proteina prionica è l’agente causale delle encefalopatie spongiformi trasmissibili nelle sue varie forme (umana, ovina e bovina). • Nel nostro organismo sulla superficie dei neuroni e delle cellule gliali è presente una forma normale non infettiva che si differenzia dalla forma infettiva solo nella struttura secondaria (un certo numero di αeliche sono sostituite da β-foglietto nella forma infettiva) permettendo al tessuto di riconoscerla come diversa dalla forma normale. • La struttura primaria e le modificazione post-traduzionali delle due forme sono identiche • La forma infettiva è resistente alla proteolisi e funge da stampo per la versione normale. • Le particelle infettive tendono a formare aggregati insolubili di fibrille che provocano la degenerazione del tessuto nervoso . Encefalopatie spongiformi trasmissibili I 4 livelli della struttura delle proteine: schema riassuntivo Proteine fibrose e proteine globulari Proteine fibrose • L’a-cheratina, il collageno e l’elastina sono proteine fibrose che conferiscono resistenza ed elasticità alle strutture di cui fanno parte. • Hanno strutture relativamente semplici e sono tutte insolubili in acqua per la presenza di elevate concentrazioni di residui idrofobici. • L’a-cheratina e il collageno si sono evoluti con strutture capaci di resistere alla tensione. • L’a-cheratina è presente nei capelli, nella lana, nelle unghie, nelle penne, negli strati esterni della pelle. • Il collageno è presente nei tendini, nella cartilagine, nella matrice organica delle ossa e nella cornea dell’occhio. La loro resistenza alla tensione è dovuta all’avvolgimento di più catene elicoidali unite a formare una superelica, incrementata da legami covalenti trasversali tra le catene. Collageno • L’elastina è costituita da subunità polipeptidiche dette tropoelastina. L’elasticità le viene impartita dalla presenza di aminoacidi modificati chiamati desmosina che sono in grado di unire catene di tropoelastina in disposizioni tali da poter essere stirate in modo reversibile in tutte le direzioni. Proteine globulari • Enzimi • Mioglobine ed emoglobina • Trasportatori Quesiti: 1)Quali sono I livelli di organizzazione strutturale delle proteine 2)Descrivere la struttura terziaria delle proteine 3)Che tipo di struttura è l’alfa-elica. Quali sono i legami che stabilizzazo l’ alfaelica? 4) Quali sono le interazioni che stabilizzano la struttura di una proteina? 5)Che cosa si intende per DOMINIO di una proteina globulare? 6)In che cosa consiste la DENATURAZIONE di una proteina 7)Proteine multimeriche, rapporto struttura funzione 8)Proteine fibrose e proteine globulari esempi e proprieta’.
Scarica