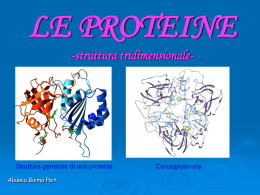
BIOMOLECOLE – STRUTTURA E FUNZIONE Lo studio delle relazioni tra struttura e funzione nelle biomolecole è uno degli aspetti più importanti per la comprensione del funzionamento dei processi biologici “La parola proteina, che ti propongo... vorrei derivasse da proteios, perche sembra essere la sostanza primitiva o principale della nutrizione animale che le piante preparano per gli erbivori,e che quest’ultimi forniscono ai carnivori”. J. J. Berzelius, lettera a G. J. Mulder, 1838 Tutti gli organismi viventi sono formati da cellule e, nonostante varino in termini di forma, dimensione e aspetto, gran parte della materia che le costituisce è di natura macromolecolare (biopolimeri) composta principalmente da carbonio, idrogeno, azoto e ossigeno. Questi quattro elementi insieme costituiscono circa il 99% della massa della maggioranza delle cellule. La chimica dei viventi è organizzata intorno all’atomo di carbonio che da solo costituisce più della metà del peso secco della cellula. Il carbonio, grazie alla sua capacità di formare quattro legami covalenti ed essere in grado, per la sua dimensione, di formare doppi e tripli legami, ha la possibilità di realizzare con altri atomi di carbonio catene più o meno lunghe, lineari o ramificate, oppure chiuse ad anello. L’esistenza praticamente illimitata di molecole diverse rendono questo elemento fondamentale per l’esistenza della vita. Le complesse funzioni biologiche richieste di un organismo necessitano di strutture molecolari altrettanto complesse diverse per dimensione, forma e composizione, che nessun altro elemento chimico all’infuori del carbonio è in grado di realizzare. È quindi possibile l’esistenza di macromolecole con le caratteristiche necessarie per sostenere, ad esempio, l’azione meccanica della cellulosa nelle piante o la possibilità di immagazzinare l’informazione genetica. La conoscenza e la comprensione della chimica di queste biomolecole è quindi necessaria per capire il funzionamento non solo della cellula ma di tutto l’organismo vivente. Dal punto di vista strutturale e funzionale e della composizione chimica, i biopolimeri vengono generalmente divisi in tre classi principali: proteine, polisaccaridi e acidi nucleici. Queste macromolecole si formano a partire da precursori relativamente semplici con peso molecolare inferiore o uguale a 500 e contengono un gran numero di monomeri e presentando un peso molecolare elevato che va da 5000 fino a più di 1 milione per le proteine, di milioni per i polisaccaridi e fino ad alcuni miliardi per gli acidi nucleici. Un’altra classe di biomolecole di notevole importanza biologica è quella dei lipidi, i quali svolgono diversi ruoli all’interno delle cellule: servono come molecole fornitrici e di riserva di energia e come componenti strutturali delle membrane cellulari. Le singole molecole lipidiche sono relativamente piccole (con pesi molecolari che vanno da 750 a 1500), ma possono associarsi attraverso legami non covalenti per formare strutture molto estese come le membrane cellulari. 1 Figura 1 - Struttura di un generico amminoacido. Il gruppo R legato al carbonio è diverso in ogni amminoacido Quello che tutte le macromolecole biologiche e gli assemblaggi lipidici hanno in comune è che essi adottano strutture tridimensionali definite che sono la chiave delle loro funzioni. La struttura tridimensionale della macromolecola può essere descritta in termini di configurazione e conformazione. La prima corrisponde alla disposizione spaziale permanente degli atomi ed è determinata dalla presenza di doppi legami (isomeria geometrica) o di centri chirali attorno ai quali sono disposti i gruppi sostituenti (stereoisomeria). Due isomeri non possono convertirsi tra loro senza la rottura di uno o più legami. La conformazione rappresenta invece la disposizione spaziale che i vari gruppi possono assumere per rotazione interna ai legami semplici senza la rottura di alcun 1 legame . Tutte le macromolecole biologiche sono caratterizzate da sequenze specifiche di monomeri (struttura primaria) che determinano la loro struttura e funzione. La relazione tra struttura e funzione particolarmente evidente nelle proteine che sono molecole formate da amminoacidi, composti bifunzionali contenenti un gruppo amminico (-NH2) e un gruppo carbossilico (-COOH) legati allo stesso atomo di carbonio e che differiscono l’uno dall’altro per la catena laterale (fig.1). Sequenze diverse di amminoacidi generano strutture che possono avere compiti molto diverse come attività catalitica (enzimi), protezione immunologica (anticorpi), trasporto, funzione strutturale, coordinamento dell’attività Figura 2 - Struttura dei 20 amminoacidi presenti nelle proteine. Nello schema ad anello, che non rappresenta nessuna proteina reale, gli amminoacidi sono posti l’uno accanto all’altro in base alle proprietà chimiche delle catene laterali – (R. F. Doolittle - Le proteine - Le Scienze n° 208 (1985)) Figura 3 – Strutture dei due enantiomeri di un amminoacido con il carbonio asimmetrico. Le due strutture sono l'una l'immagine speculare dell'altra 1 Vedi lezione Treccani: Dai gruppi funzionali ai polimeri 2 neuronale, controllo genetico ecc.. Le proteine sono le macromolecole biologiche più abbondanti nelle cellule e sono sempre formate dalla stessa serie di 20 amminoacidi sia che appartengano alle specie batteriche che agli organismi superiori (fig.2). A differenza di polimero sintetico come il polietilene o il nylon che presentano proprietà limitate, le proteine sono molto più versatili perché presentano unità monometriche con catene laterali diverse per struttura, dimensione e carica. Queste possono essere idrocarburiche, come nel caso della valina, leucina ed isoleucina, possono presentare un gruppo basico come nella lisina, arginina e istidina o possono contenere un gruppo carbossilico come nell’acido aspartico e glutammico. A causa della Figura 4 - Reazione di condensazione disposizione tetraedrica del carbonio, tutti gli tra due amminoacidi con la formazione di un dipeptide e l'eliminazione di una amminoacidi, ad eccezione del più semplice, la molecola d'acqua glicina, posseggono un carbonio asimmetrico. Dei due possibili stereoisomeri che si trovano nelle proteine idrolizzate solo uno due enantiomeri, quello definito L, è presente e la configurazione è la stessa per tutti gli amminoacidi (fig. 3). Le molecole di amminoacidi nelle proteine sono legate insieme attraverso reazioni di condensazione con eliminazione di una molecola d’acqua e la formazione del legame chiamato peptididico (fig. 4). Potendo un amminoacido legarsi ad altri 19, il Figura 5 – Forme limiti di risonanza numero delle combinazioni cresce rapidamente per il legame peptidico all’aumentare delle dimensioni della catena. Comunque, lo studio degli archivi di sequenze proteiche mostra chiaramente che i residui amminoacidici non sono presenti con uguale frequenza nelle proteine e le sequenze rappresentano solo una piccola parte di tutte le possibili combinazioni. Ad esempio, il triptofano e la cisteina sono residui rari nelle proteine, meno del 2% di tutti i residui, mentre l’alanina, glicina e leucina sono presenti con una frequenza dal 7 al 9%. Tra tutte le conformazioni che una proteina che contiene centinaia di atomi può assumere, solo una (o poche) sono quelle che predominano nelle condizioni biologiche. Quando una proteina è in uno di questi stati conformazionali funzionali è detta nativa. Esistono una serie di vincoli che determinano la conformazione delle proteine. Il primo deriva dal fatto che il legame peptidico formato tra i gruppi carbonilico e amminico non può ruotare liberamente. Questo può essere giustificato assumendo che il legame peptidico possa essere descritto come un ibrido di risonanza delle due formule limiti I e II mostrate in fig. 5. 3 Figura 6 - Legame peptidico. i due carboni alfa sono separati da tre legami che sono coplanari Dalla teoria della risonanza deriva che la molecola reale non corrisponde né alla formula limite I né a II, ma è una combinazione delle caratteristiche di entrambe. Così il legame C-N avrà nella realtà un non trascurabile carattere di doppio legame e una struttura più o meno planare, con angoli vicini a 120°, necessaria per permettere la coniugazione del doppietto elettronico. Studi cristallografici ai raggi X confermano che la lunghezza del legame peptidico è intermedio (1,33 Å) tra quello aspettato per un semplice legame C-N (1.45 Å) e quello di un doppio legame C=N (1.25 Å). L'accentuato carattere di doppio legame tra C e N impedisce la libera rotazione intorno a questo legame e porta i sei atomi del gruppo peptidico ad essere coplanari (fig.6). Lo scheletro della catena polipetidica si può quindi considerare come una serie di piani rigidi in cui i piani consecutivi hanno in comune un legame Cα–C o N–Cα in grado esibire mobilità rotazionale. Come risultato della restrizione rotazionale sono possibili due conformazioni, quella trans o quella cis. Per motivi sterici la configurazione trans è preferita di un fattore 103, tranne quando l’ultimo amminoacido della catena è una prolina. In tal caso, a causa della natura ciclica del residuo che determina una minore repulsione sterica tra i lati della catena, la differenza energetica tra configurazione cis e trans è solo di un fattore 4. La conformazione della proteina è determinata dai due angoli diedri, Φ e Ψ, che riflettono le rotazioni intorno a ciascuno dei due legami (N—C per Φ e C —C per Ψ) che si ripetono lungo lo scheletro della molecola e che possono assumere solo alcuni valori (fig.7). Anche se in linea di principio Φ e Ψ possono assumere qualsiasi valore compreso tra 180° e + 180°, molti non sono permessi per motivi di impedimento sterico tra gli atomi dello scheletro e le catene laterali. Le conformazioni stericamente proibite sono quelle per cui la distanza interatomica di un’interazione non covalente è inferiore alla corrispondente somma di raggi di van der Waals. In base ai raggi atomici degli elementi della catena, sono possibili soltanto valori di Φ e Ψ che cadono in alcune zone del cosiddetto grafico di Ramachandran (fig.8), dal nome del fisico indiano G.N. Ramachandran che alla fine anni ’60, per primo calcolò le regioni stericamente Figura 8 - Grafico di Rachamandran per due residue di L-alanina. Le permesse, e in cui gli angoli zone verdi rappresentano conformazioni con valori di Φ e Ψ Ψ sono riportati in funzione permessi in cui non si hanno interazioni steriche di Φ. Figura 7 - La rotazioni dei legami N-C e C -C descrivono due angoli diedri, chiamati rispettivamente Φ e Ψ 4 Le zone in verde scuro sono quelle largamente permesse, mentre le zone in verde chiaro indicano le conformazioni, comunque possibili, che hanno distanze di van der Waals al limite inferiore dell’accettabilità. Solo il 25-30 % del diagramma è occupato da zone stericamente permesse. Nelle proteine i legami covalenti limitano le forme che queste possono assumere, ma sono le interazioni non covalenti che determinano le conformazioni stabili e al tempo stesso flessibili che permettono ad esse di svolgere le loro funzioni biologiche. Sono le proprietà delle catene laterali le principali responsabili del ripiegamento di una catena polipeptidica. Le interazioni di una catena laterale con un'altra e con le molecole presenti nel mezzo circostante possono determinare il ripiegamento della proteina in una conformazione stabile. Queste interazioni sono molto più deboli dei legami covalenti (l’energia è ad esempio dell’ordine dei 350 kJ/mole per i legami CC) e possono variare da 0,1 a 30 kJ/mole. I più importanti sono: il legame idrogeno, le interazioni ioniche, le forze di van der Waals e le interazioni idrofobiche2 (fig.9). Analizzando il contributo delle interazioni alla stabilità delle proteine, si osserva che quelle predominanti sono le interazioni idrofobiche. Le molecole di acqua formano Figura 9 - Interazioni deboli presenti nella tra loro numerosi legami idrogeno. La proteina presenza di una molecola rompe i legami idrogeno e le molecole d’acqua tendono a circondare la struttura idrofobica riarrangiandosi in un guscio di molecole molto più ordinato unite da legami idrogeno chiamato strato di solvatazione. Poiché il numero di modi con cui le molecole d’acqua formano legami idrogeno sulla superficie di un gruppo non polare è inferiore a quello che farebbero in sua assenza si ha una diminuzione sfavorevole di entropia del sistema. La conseguenza è che la catena polipeptidica tende ad avvolgersi in modo tale da esporre in superficie le catene laterali polari e posizionando all’interno quelle non polari in modo da ridurre la dimensione dello strato di solvatazione, poiché meno molecole d’acqua sono ordinate intorno alle molecole apolari. Questo determina un aumento di entropia che costituisce la forza termodinamica principale alla stabilizzazione della proteina. Le strutture delle proteine sono estremamente complesse, ma alcuni elementi si trovano frequentemente. Questi elementi rappresentano la cosiddetta struttura secondaria delle proteine. Con il termine di struttura secondaria si intendono le disposizioni regolari della catena polipeptidica principale, che vengono classificate senza fare riferimento al tipo di catena laterale degli amminoacidi o con altri segmenti della proteina. 2 Vedi lezione Treccani: Le forze intermolecolari 5 Esse sono stabilizzate da legami idrogeno fra il gruppo amminico e il gruppo carbonilico della catena principale. La regolarità di una struttura si ha quando ogni angolo φ e ψ rimane invariato all’interno del segmento di proteina. Si possono distinguere tre tipi principali di strutture secondarie: elica , foglietto β e reverse turn. I segmenti di catena polipeptidica che non sono in elica, foglietto β o turn Figura 10 - Struttura secondaria elica di una proteina assumono la conformazione chiamata loop o random coil, struttura non ripetitiva né regolare, spesso priva di legami idrogeno tra gli aminoacidi che la compongono. Circa il 70-80 % degli aminoacidi delle Struttura secondaria alfa elica di una proteina proteine globulari assume la conformazione regolare tipica di uno dei tre tipi di struttura secondaria. L’ elica è la struttura secondaria più adottata dalla catena polipeptidica delle proteine: circa il 32-38 % degli aminoacidi delle proteine globulari di struttura tridimensionale nota assume questa conformazione (fig. 10). Essa fu descritta per la prima volta nel 1951 da Linus Pauling e Robert Corey (California Institute of Technology), i quali proposero una struttura stabile basata su gli angoli e sulle distanze di legame calcolate sperimentalmente sulla base dell’analisi cristallografica per gli amminoacidi e i peptidi. La prova sperimentale dell’esistenza di queste strutture si ebbe con la determinazione della struttura tridimensionale delle mioglobina (John Kendrew, 1960) e dell’emoglobina (Max Perutz, 1961), due proteine che presentano eliche come elementi di struttura secondaria. L’α elica presenta un avvolgimento destrorso ed è caratterizzata da un angolo φ = 57° ed un angolo ψ = -47°, che corrispondono alla posizione nel quadrante in basso a sinistra del plot di Ramachandran. Ogni giro d’elica contiene 3,6 residui ed ogni amminoacido si estende per 1,5 Å lungo la catena determinando un passo dell’elica pari a 5,4 Å (fig. 10B). La struttura è stabilizzata da legami idrogeno che si formano tra l’atomo di idrogeno legato all’atomo di azoto di un legame peptidico e l’atomo di ossigeno carbonilico del quarto amminoacido successivo (fig.10A) e ciascun legame peptidico, tranne quelli vicino all’estremità dell’elica, partecipa alla formazione di legami idrogeno. Le catene laterali degli aminoacidi che appartengono ad un’α Figura 11 - Struttura della elica destrorsa sono rivolte verso l’esterno e verso prolina l’estremità N-terminale dell’elica così da evitare interferenze steriche con la catena polipeptidica principale e tra le catene laterali stesse. La sequenza amminoacidica influenza la capacità di formare delle eliche. Ciò dipende dalle proprietà del residuo R dell’amminoacido che influenzano i valori caratteristici degli angoli Φ e Ψ. Ad esempio, residui con gruppi carichi sono fortemente influenzati dal pH dell’ambiente. A pH 7, i gruppi carbossilici del 6 glutammato adiacenti si respingono così come i residui carichi positivamente dell’arginina, destabilizzando la formazione dell’elica. Altro esempio è la presenza della prolina (fig.11) che presenta un atomo di azoto del gruppo amminico che fa parte di un anello rigido e che non rende possibile la rotazione del legame N-Ca introducendo un ripiegamento che destabilizza l’elica. Inoltre, non avendo l’idrogeno sul gruppo amminico, non può formare il legame H con altri residui. Nel 1951 Pauling e Corey ipotizzarono anche l’esistenza di un’altra struttura secondaria: la conformazione . Essa è formata in media da 5 a 10 aminoacidi, con la catena polipeptidica quasi completamente estesa. Le catene polipeptidiche sono disposte l’una accanto all’altra in modo tale che si possano formare legami idrogeno tra i gruppi CO di un filamento e i gruppi NH del filamento β adiacente e viceversa, formando una struttura che presenta una serie di pieghettature e che è detta foglietto β. Le catene laterali degli aminoacidi che compongono il foglietto β seguono lo stesso andamento, per cui puntano alternativamente sopra e sotto il foglietto β. Le catene polipeptidi che possono interagire fra loro a formare i foglietti β in due modi diversi:parallele o antiparallele a seconda che abbiano lo stesso orientamento o un orientamento opposto del legame NH-CO (fig. 12). Gli angoli diedri (φ, ψ) della catena polipeptidica in conformazione foglietto β cadono nella zona permessa del grafico di Ramachandran corrispondente al quadrante in alto a sinistra: φ=-139°, ψ=135° (parallelo) e φ=-119°, ψ=113° (antiparallelo). I reverse turn sono ripiegamenti che collegano due filamenti β antiparalleli Figura 12 - Struttura secondaria β elica. a) adiacenti. In questo caso sono due gli foglietto ripiegato antiparallelo; b) foglietto amminoacidi non coinvolti nei legami idrogeno ripiegato parallelo tra i filamenti β in quanto si forma un legame idrogeno tra il gruppo CO dell’aminoacido 1 e il gruppo NH dell’amminoacido 4. Questo tipo di ripiegamento si osserva nelle proteine globulari, che presentano una struttura ripiegata e compatta. Le regioni loop o random coil sono costituite da zone della catena polipeptidica che non assumono alcun tipo di struttura secondaria nel senso che le coppie (φ, ψ) degli amminoacidi che li compongono presentano valori diversi e non costanti ed hanno la funzione di collegare elementi di struttura secondaria. La disposizione spaziale degli atomi di una proteina è definita come struttura terziaria e si distingue da quella secondaria in quanto questa riguarda la disposizione dei residui amminoacidici adiacenti nella sequenza polipeptidica. La struttura terziaria quindi, prende in considerazione delle interazioni a lungo raggio nella sequenza primaria della proteina, che possono essere legami deboli e talvolta legami covalenti come ponti disolfuro. Per proteine globulari di 140 o meno residui, la struttura tridimensionale ha una forma sferica compatta formata da motivi di struttura secondaria con poche irregolarità strutturali. Per proteine più grandi la struttura terziaria può essere organizzata in più 7 unità strutturali chiamate domini. I diversi domini della proteina, interagiscono tra loro con minori interazioni rispetto a quelli tra gli elementi strutturali secondari all’interno del dominio. In molti casi un dominio di una proteina mantiene la sua struttura terziaria anche se viene separato mediante una scissione idrolitica dal resto della catena polipeptidica. Molte proteine sono formate da più catene polipeptidiche e le interazioni tra queste catene ne definiscono la struttura quaternaria. Queste strutture possono essere dovute a proteine con diverse o uguali subunità. Ad esempio emoglobina è un tetramero formato da due differenti subunità denominate alfa e beta, mentre la proteasi HIV è un omodimero (fig.13). Le subunità sono mantenute insieme da un gran numero interazioni non covalenti che nonostante siano individualmente deboli determinano una notevole stabilità. La struttura quaternaria è mostrata da proteine che Figura 13 - Strutture quaternarie. A Proteasi HIV; B Emoglobina svolgono funzioni catalitiche con la formazione di siti catalitici o di legame con il substrato all’interfaccia tra le subunità. Un ulteriore vantaggio di queste strutture è che l’interazione della proteina con il substrato o con i leganti causa cambi conformazionali all’interno della struttura ed offre la possibilità di regolare l’attività biologica. Questa è la base delle cosiddetta regolazione allosterica negli enzimi3. Le proteine vengono sintetizzate nelle cellule sui ribosomi come Figura 14 – Nell’esperimento di Anfinsen, la ribonucleasi sequenza lineari di amminoacidi. viene denaturata con urea e mercaptolo per ridurre e Successivamente queste si scindere i ponti disolfuro. La rinaturazione ristabilisce i ponti avvolgono (folding) per assumere disolfuro e riporta la struttura nel suo stato nativo la loro conformazione nativa che è quella funzionale. La struttura tridimensionale della proteina è determinata dalle interazioni tra i residui amminoacidici, quindi dalla sua struttura primaria. Queste 3 In una proteina allosterica il legame con un ligando a livello di uno specifico sito di legame modifica le proprietà di un altro sito sulla stessa molecola proteica attraverso una modificazione conformazionale 8 interazioni sono distrutte dall’azione della temperature, in soluzioni alcaline o acide o per addizione di sostanze come alcol o urea. Questo processo, che determina la perdita della struttura terziaria e dell’attività della proteina è detto denaturazione. Molte proteine, dopo essere state denaturate, sono in grado di ripiegarsi spontaneamente nella propria conformazione nativa riacquistando la loro attività biologica. L’esperimento di C. Anfinsen (1957) sulla ribonucleasi A (RNasi) ha dimostrato che questa proteina se denaturata e ridotta riassume la sua conformazione nativa e riforma i corretti 4 punti disolfuro quando viene rimosso il denaturante e il riducente (fig.14). Il ruolo di tale proteina è quello di catalizzare l’idrolisi delle molecole di RNA a livello dei legami fosfodiestere e pertanto la sua attività si misura in base alla capacità di idrolizzare le molecole di RNA. Questo risultato indica che la sequenza peptidica contiene tutta l’informazione necessaria perché la proteina possa avvolgersi nella sua struttura tridimensionale dello stato nativo. Dal punto di vista termodinamico lo stato nativo nelle condizioni fisiologiche costituisce un minimo dell’Energia Libera di Gibbs. Ma una volta che la proteina è sintetizzata come fa a ripiegarsi nella conformazione nativa, dato che l’esplorazione casuale di tutte le possibili conformazioni fino a raggiungere quella corretta non è possibile? Figura 15 - L’asse verticale rappresenta l‟energia libera interna di ogni specifica Infatti, ammettendo soltanto 10 conformazione mentre l’asse orizzontali possibili per ogni residuo rappresenta il numero di conformazioni (quindi conformazioni l’entropia conformazionale). La forma ad imbuto amminoacidico, una sequenza di 100 descrive la progressiva riduzione dello spazio presenta un numero di conformazionale. Inizialmente sono presenti amminoacidi 100 molte strutture che diminuiscono fino ad conformazioni possibili paria a 10 e se per arrivare alla proteina nello stato nativo che è caratterizzata da un unico sottostato ogni cambio di conformazione è necessario conformazionale. un tempo pari a circa 10-13 s, il tempo totale per provare tutte le conformazioni sarebbe pari a 10 87 s (l’età dell’Universo è stimata in 20 miliardi di anni che corrispondono a 6.1017 s)! Questo problema è noto come paradosso di Levinthal (1968). Dato che i tempi di folding vanno da qualche secondo ad alcuni minuti, è evidente che l’evoluzione ha trovato una soluzione efficace a questo procedimento. Le cellule d’Escherichia coli, ad esempio, sintetizzano una molecola proteica di 100 amminoacidi in circa 5 secondi alla temperatura di 37°C. Le proteine si ripiegano seguendo vie dirette senza ricercare casualmente la conformazione nativa tra le molte possibili. Sono stati proposti diversi modelli per spiegare questo processo. Il primo, detto gerarchico, prevede che le proteine inizialmente diano luogo a strutture secondarie (α eliche, foglietti β) seguite da interazioni a lungo raggio tra queste che portano alla formazione di domini ed infine alla conformazione nativa (fig. 15). Nel secondo modello, detto globulo fuso (molten globule) il ripiegamento iniziale della proteina è favorito dalla formazione di uno stato compatto dovuto a interazioni idrofobiche tra residui non polari (collasso idrofobico). Il molten globule ha molte delle strutture secondarie dello stato maturo ma è meno 9 compatto e le interazioni all'interno della proteina non sono forti in quanto molte catene amminoacidi non hanno ancora assunto una giusta conformazione. È probabile che la maggior parte delle proteine si ripieghi attraverso un processo che segue i due modelli, attraverso conformazioni intermedie diverse il cui numero tende a diminuire via via che il processo di avvolgimento tende verso la struttura finale nativa. L’andamento termodinamico del processo di ripiegamento può essere rappresentato come un imbuto il cui restringimento rappresenta una diminuzione delle specie a diversa conformazione. Le depressioni lungo le parti esterne dell’imbuto rappresentano conformazioni transitorie che persistono fino a che mediante attivazione termica casuale viene superata la barriera energetica con decadimento in conformazione ad energia minore. Figura 16 - I chaperoni si presentano forma di Molte proteine per avvolgersi hanno bisogno capsule e sono in grado di fornire un ambiente della presenza di altre proteine dette sicuro per il giusto ripiegamento della proteina. Una volta che la proteina ha assunto la corretta chaperoni molecolari, che interagiscono con struttura viene rilasciata la proteina parzialmente ripiegata facilitandone il corretto ripiegamento impedendo l’associazione scorretta di zone idrofobiche (fig. 16). La comprensione dei meccanismi molecolari, che sono alla base del folding delle proteine rappresenta un importantissimo obiettivo in quanto esso fornirebbe la possibilità di curare molte patologie associate ai processi di avvolgimento in una forma sbagliata della proteina (misfolding). Ad esempio nella fibrosi cistica è presente un difetto nella proteina transmembrana che agisce come un canale degli ioni cloro nelle cellule epiteliali (1480 amminoacidi) che non si avvolge correttamente a causa di una mutazione con la delezione di un amminoacido (Phe 508). Essa determina principalmente la produzione di secrezioni molto ricche in sodio e cloro; il muco è denso e vischioso e tende ad ostruire i dotti nei quali viene a trovarsi. In questi ultimi anni, grazie all’utilizzo di potenti Figura 17 - Alcuni esempi di strutture computer, si sono sviluppati dei metodi computazionali di proteine analizzate mediante il aventi lo scopo di predire la struttura tridimensionale di metodo Rosetta. una proteina partendo dalla sola conoscenza della sua A: fattore di trascrizione MarA legato al DNA; sequenza amminoacidica e di comprendere come B: batteriocina AS-48; avviene il ripiegamento nelle strutture native. C: Secondo dominio del MutS. A sinistra sono riportate le struttura Tra questi, c’è ad esempio l’algoritmo sviluppato dal determinate mediante i raggi x, gruppo di David Baker chiamato Rosetta, con grande mentre a destra le strutture previste capacità predittiva. Esso divide la sequenza primaria teoricamente in gruppi di alcuni residui (da 3 a 9) ed effettua una 10 ricerca su frammenti di strutture proteiche note presenti in un database e provenienti da strutture cristalline, generando così per ogni frammento una serie di strutture possibili. Vengono poi analizzate tutte le combinazioni e le varie conformazioni valutate con varie funzioni di scoring in modo da trovare quella a più bassa energia. Questo metodo offre un valido aiuto nella ricerca sulle possibili strutture locali restringendo notevolmente il numero di conformazioni da analizzare. Questo metodo di previsione ha partecipato con grande successo ad una competizione chiamata CASP (Critical Assessment of Methods for Protein Structure Prediction), nella quale team di ricercatori da tutto il mondo cercano di prevedere le strutture di proteine la cui struttura è stata recentemente determinata sperimentalmente, ma che non è ancora stata resa pubblica. In fig. 17 sono riportate alcune strutture previste da Rosetta confrontate con quelle risolte sperimentalmente mediante analisi ai raggi X. 11
Scaricare