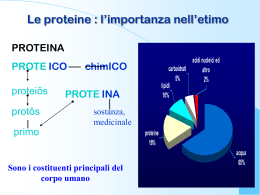
Le proteine: come sono fatte, come funzionano, e come si sono evolute. Il vero dogma centrale della biologia: la sequenza determina la struttura, che determina la funzione Proteine parte 1a prof. S. Sorrentino Le Proteine sono i costituenti principali del corpo umano carboidrati 5% lipidi 10% acidi nucleici ed altro 2% proteine 18% acqua 65% Pròteios: “primario” Le proteine sono i costituenti principali dell’architettura molecolare di tutte le cellule Le Proteine sono macromolecole ma…… 1 nm = 10-9 m La maggior parte di esse è invisibile anche con il più potente microscopio elettronico Le proteine sono le macromolecole polimeriche più versatili della cellula, ma non sono dei semplici polimeri lineari di amminoacidi. Ogni proteina assume la struttura tridimensionale più adatta alla funzione che svolge in un determinato organismo Le Proteine: - Non sono dei semplici polimeri lineari di amminoacidi. - Presentano complesse strutture tridimensionali. - Sono sintetizzate dai ribosomi e, in frazioni di secondo, assumono la struttura tridimensionale più adatta alla funzione che devono svolgere. - Già “conoscono” il loro ruolo e “sanno” come organizzare la loro architettura molecolare. - L’informazione è contenuta nella sequenza degli amminoacidi che è stabilita dal tratto di DNA (gene) il quale contiene il “progetto” e le “istruzioni per il montaggio” di ogni specifica proteina. Il dogma centrale della biologia DNA: detentore dell’informazione genetica organizzata in unità detti geni. RNA: traduce l’informazione genetica nel linguaggio delle proteine. trascrizione Nei virus con patrimonio genetico a RNA con meccanismo replicativo che utilizza la trascrittasi inversa (Retrovirus) è possibile il passaggio inverso, cioè ottenere il DNA partendo da RNA. traduzione •La funzione che una proteina svolge è strettamente legata alla struttura tridimensionale che la proteina assume •La struttura tridimensionale finale è quella più stabile e viene raggiunta attraverso vari livelli di organizzazione strutturale •Tali livelli di organizzazione dipendono dalla sequenza degli amminoacidi che è geneticamente determinata. Gli amminoacidi possono esistere sottoforma di due enantiomeri o stereoisomeri. Le proteine contengono solo amminoacidi Gli L-amminoacidi possono essere levogiri o destrogiri. Le proprietà ottiche non dipendono dalla serie stereochimica. Struttura primaria delle proteine La sequenza, unica per ogni proteina, determina la forma degli altri livelli strutturali (secondaria, terziaria e quaternaria) e quindi, la funzione biologica. Se un amminoacido in posizione chiave è sostituito con un altro, anche la forma della proteina cambia e anche la sua funzionalità. Infatti, anche le parole assumono significato diverso se le stesse lettere sono poste in una sequenza diversa. Ad esempio: -R-O-M-A- A-M-O-R- -M-O-R-A- -R-A-M-O- Legame peptidico ΔG = ΔH - TΔS Limitazioni alla libera rotazione Impedimenti sterici: i gruppi peptidici e le catene laterali per particolari valori degli angoli Φ e Ψ vengono a trovarsi a distanza di contatto. I piani degli amminoacidi devono ruotare affinché la proteina si ripieghi assumendo la forma più stabile e cioè quella a più bassa energia In natura tutto tende a raggiungere un minimo di energia ΔG = ΔH – T ΔS Entropia Entalpia Un processo è spontaneo se ΔG<0 - diminuendo ΔH - aumentando ΔS I PIANI DEI GRUPPI PEPTIDICI RUOTANO FAVORENDO LA FORMAZIONE DELLA STRUTTURA SECONDARIA AVVICINAMENTO DI GRUPPI ATOMICI CAPACI DI FORMARE LEGAMI A IDROGENO (gruppi N-H e C=O di ogni legame peptidico) DIMINUISCE ΔH ΔG = ΔH – T ΔS ΔG <0 Sequenza –C-C-N- α Elica Foglietto β Struttura secondaria delle proteine Struttura primaria amminoacidi β foglietto α elica Struttura secondaria β struttura α struttura Struttura terziaria Struttura quaternaria Disposizione regolare e ripetitiva assunta dalla catena proteica nello spazio E’ stabilizzata da legami a idrogeno intracatena tra i gruppi C=O e N-H di due a.a. diversi Struttura secondaria delle proteine α elica ripiegamento elicoidale della catena proteica che si presenta come un nastro avvolto intorno ad un asse centrale. E’ stabilizzata da legami a idrogeno intracatena tra i gruppi C=O e N-H di dua a.a. anche lontani Le catene laterali R dei residui amminoacidici sono tutte rivolte verso l'esterno dell'elica β-foglietto Si presenta come un ripiegamento più ordinato a zig zag simile ad un ventaglio Le catene laterali sporgono alternativamente al di sopra e al di sotto del piano Filamento pieghettato Struttura secondaria delle proteine Direzione parallela NH2 COOH NH2 COOH NH2 COOH Direzione antiparallela NH2 COOH COOH NH2 NH2 COOH
Scaricare