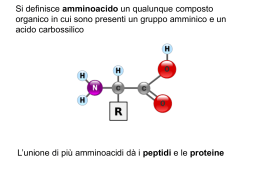
Raffaella Aragona Struttura degli amminoacidi • Ogni amminoacido (eccetto la prolina) possiede un carbonio centrale, chiamato carbonio a, al quale sono legati quattro differenti gruppi: • un gruppo amminico basico (-NH2) • un gruppo carbossilico acido (-COOH) • un atomo di idrogeno (-H) • una catena laterale, diversa per ciascun amminoacido (-R) Il legame peptidico: Nelle proteine quasi tutti i gruppi carbossilici e amminici degli amminoacidi sono uniti in legami peptidici R O H N C H H R C + OH O H N C H H H C OH • Le proprietà di ciascun amminoacido dipendono dalle catene laterali (-R) che sono responsabili della struttura, delle funzioni e della carica elettrica delle proteine • Gli amminoacidi possono essere classificati in base alle proprietà delle loro catene laterali (-R) • Gli amminoacidi con catene laterali cariche, idrofiliche, sono generalmente esposti sulla superficie delle proteine • I residui idrofobici, non polari, si trovano in genere all’interno delle proteine, protetti dal contatto con l’acqua Dal punto di vista biochimico gli amminoacidi si possono classificare in: • Essenziali: quegli AA che una determinata specie non è in grado di sintetizzare (o li sintetizza in quantità non sufficienti *); - devono essere introdotti con la dieta - Phe, Val, Thr, Try, Ile, Met, Leu, Lys, His*, Arg* (* sono necessari nella dieta solo durante lo stadio giovanile di crescita) • Non essenziali: quegli AA che una determinata specie è in grado di sintetizzare. La struttura delle proteine • Le proteine possono essere organizzate in quattro livelli, in relazione fra di loro • Struttura primaria → numero, tipo e sequenza specifica degli amminoacidi che formano la proteina • Struttura secondaria → conformazione spaziale delle catene • Struttura terziaria → configurazione tridimensionale della catena polipeptidica • Struttura quaternaria → unione di due o più catene polipeptidiche Struttura primaria • La sequenza degli aminoacidi di una proteina si chiama struttura primaria. • Nelle proteine, gli amminoacidi sono uniti covalentemente con legami peptidici. • I legami peptidici sono legami ammidici tra il gruppo a-carbossilico (-COOH) di un amminoacido ed il gruppo a-amminico (-NH2) dell’amminoacido successivo. • Durante la formazione del legame peptidico viene eliminata una molecola di acqua (reazione di condensazione). La peculiare sequenza amminoacidica di una catena polipeptidica rappresenta la struttura primaria Lisozima Struttura secondaria • Si riferisce alla conformazione locale della catena polipeptidica. • E’ determinata da interazioni di tipo legame a idrogeno fra l’ossigeno di un gruppo carbonilico del legame peptidico e l’idrogeno del gruppo ammidico di un altro legame peptidico. • Esistono due tipi di strutture secondarie: l’ a-elica ed il foglietto b. Struttura secondaria strutture dovute ad interazioni “locali” di tipo ponte-H a-elica • ponte-H ogni 3,6 aminoacidi •Il legame H si instaura tra l’H dell’azoto amidico e l’O del gruppo carbonilico • residui esterni alla spirale b-foglietto • legami idrogeno fra aminoacidi di catene diverse • foglietto piegato Struttura terziaria • La struttura terziaria è la conformazione tridimensionale, avvolta, di una proteina. • La struttura primaria di una catena polipeptidica determina la sua struttura terziaria. • Quando una proteina si avvolge su se stessa, gli AA che si trovano in regioni lontane della sequenza polipeptidica possono ugualmente interagire tra loro. Struttura Terziaria • La struttura terziaria è la conformazione tridimensionale assunta da una proteina. • È stabilizzata da legami non covalenti come ponti idrogeno, interazioni idrofobiche tra amminoacidi non polari e legami ionici. È indispensabile per la sua attività biologica. La struttura terziaria è stabilizzata da 4 tipi di interazioni • Interazioni idrofobiche: gli amminoacidi con catene laterali non polari tendono a localizzarsi all’interno della molecola dove si associano con altri residui idrofobici. • Interazioni ioniche: i gruppi con carica negativa (-COO-) possono interagire con gruppi carichi positivamente (-NH3+) • Legami a idrogeno • Legami disolfuro Struttura quaternaria • Molte proteine sono costituite da una sola catena polipeptidica (proteine monomeriche). • Alcune proteine sono costituite da 2 o più catene polipeptidiche (subunità) strutturalmente identiche o diverse (proteine multimeriche). • L’associazione di queste subunità costituisce la struttura quaternaria. • Le subunità sono tenute insieme da interazioni non covalenti. Struttura quaternaria: associazione di più catene polipeptidiche Proteine globulari e fibrose Le proteine possono essere classificate in due gruppi principali: proteine globulari e fibrose. Proteine globulari • Le catene polipeptidiche sono ripiegate ed assumono forma compatta, sferica o globulare. Proteine Fibrose • Hanno catene polipeptidiche disposte in lunghi fasci o in foglietti. • Sono insolubili in H2O per la presenza di AA idrofobici. Le Proteine Fibrose • Sono di origine animali, • insolubili in acqua, • Assolvono ruoli strutturali per lo più. Si dividono in tre categorie: le cheratine i collageni le sete Formano tessuti protettivi Formano tessuti connettivi Come i bozzoli dei bachi da seta Le Proteine Globulari • Sono solubili in acqua, • di forma quasi sferica, • Assolvono funzioni biologiche. Possono essere: • Enzimi • Ormoni • Proteine di trasporto • Proteine di deposito • La denaturazione proteica Modificazione della conformazione spaziale della proteina: – perdita della struttura nativa – perdita delle proprietà fisico-chimiche e biologiche – generalmente è un processo irreversibile • Può essere causata da: – agenti fisici, ad es. calore, agitazione meccanica – agenti chimici, ad es. acidi, basi
Scaricare