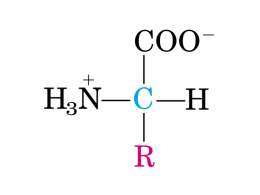
Si definisce amminoacido un qualunque composto organico in cui sono presenti un gruppo amminico e un acido carbossilico L’unione di più amminoacidi dà i peptidi e le proteine Tra i numerosi amminoacidi, solo 20 partecipano alla formazione delle proteine e, quindi, sono definiti amminoacidi proteogenici. Gli amminoacidi proteogenici: • Sono tutti a (la funzione NH2 è legata al C adiacente alla funzione carbossilica) • Sono tutti chirali (eccetto la glicina) • Presentano stereochimica L (il C chirale ha la stessa configurazione del C chirale della L-gliceraldeide) • Il C chirale ha una configurazione assoluta S (ad eccezione della cisteina, che è R) Inoltre, gli amminoacidi: • si differenziano tra loro per la natura del gruppo –R, definito residuo amminoacidico o catena laterale • si presentano come zwitterioni, cioè come ioni dipolari, in cui sono presenti, contemporaneamente, una carica positiva e una negativa Proprietà acido-basiche degli amminoacidi Gli amminoacidi sono zwitterioni (sali interni). •Hanno momenti dipolari elevati •Sono, generalmente, solubili in H2O •Sono sostanze cristalline con alti punti di fusione Il comportamento in soluzione acquosa viene influenzato dal pH Se un amminoacido in soluzione viene sottoposto all’azione di un campo elettrico esterno tenderà : • A migrare verso il catodo (elettrodo negativo) se è in forma cationica • A migrare verso l’anodo (polo positivo) se è in forma anionica • A non migrare se si trova al suo punto isoelettrico (PI) Per gli amminoacidi con una carica (+ o -) nel residuo R, il PI è: • la media dei valori di pKa più bassi, se R è un residuo acido • la media dei valori di pKa più alti, se R è un residuo basico Alcuni metodi di sintesi racema 1) Sintesi di amminoacidi da a-alogenoacidi 2) Sintesi di Strecker 3) Sintesi di Gabriel 1) da a-alogenoacidi: La reazione di amminazione fatta con NH3 dà rese basse, a causa della polialchilazione. In alternativa, si utilizza la sodio azide, che per idrogenazione catalitica, o con NaBH4 si riduce ad ammina. 2) Sintesi di Strecker 3) Sintesi di Gabriel (della glicina) PEPTIDI Il legame che si instaura fra gli amminoacidi per formare i peptidi e le proteine è un legame ammidico, detto legame peptidico Il dipeptide è il più semplice peptide, formato dall’unione di due amminoacidi Per formare il legame peptidico, un amminoacido mette a disposizione il proprio gruppo –COOH, mentre l’altro amminoacido interviene con il suo gruppo –NH2, con formazione di una molecola di H2O. I dipeptidi si indicano scrivendo i simboli dei due residui amminoacidici che li costituiscono . Per convenzione, i peptidi sono rappresentati ponendo a sx l'amminoacido con il gruppo amminico libero (a.a. N-terminale) e all'estremità di dx quello con il gruppo carbossilico libero (a.a. C-terminale) Sintesi dei peptidi Attivazione del COOH protezione del gruppo NH2 La protezione del gruppo NH2 consiste nel rendere l’N del gruppo amminico meno reattivo, cioè meno nucleofilo. Alcuni esempi di gruppi protettori dell’-NH2 Terz-butossicarbonile (Boc) Viene introdotto facilmente facendo reagire l’-NH2 con il di-terz-butil dicarbonato (Boc-anidride), e rimosso facilmente per idrolisi acida Carbobenzilossi cloruro (benzilcloroformiato) Viene facilmente introdotto sul gruppo amminico (SNacilica), in presenza di basi per neutralizzare l’HCl che si forma, e rimosso altrettanto facilmente per idrogenazionecatalitica Fluorenilmetossicarbonil cloruro Viene rimosso facilmente tramite idrolisi debolmente basica •La sintesi di una catena peptidica per addizione sequenziale di un amminoacido richiede un processo accurato di purificazione del prodotto ottenuto, poiché ad ogni passaggio sintetico è necessario isolarlo dal solvente, dai sottoprodotti, dall’eccesso di reagenti Resina più usata: Granuli di polistirene-divinilbenzene contenenti gruppi clorometilici. Ha lo svantaggio di dover essere rimossa in condizioni acide drastiche (HF) Resine più innovative: non hanno bisogno di un acido forte per essere rimosse Passaggi della sintesi in fase solida 1) Un amminoacido (es. valina) N-Boc protetto si lega alla resina per reazione con i gruppi clorometilici. 2) L’amminoacido viene lavato per liberare dall’eccesso di reagente e trattato con acido trifluoroacetico per rimuovere il –Boc. 3) Il secondo amminoacido N-Boc protetto e –COOH attivato condensa con il primo amminoacido (valina) 4) Il dipeptide N-Boc-Val-Phe viene lavato e trattato con acido trifluoroacetico per rimuovere il Boc. Il ciclo si ripete n volte, fino all’ottenimento del peptide desiderato 5) L’ultimo passaggio prevede il distacco dell’amminoacido dalla resina, ad opera di HF che rimuove anche il Boc. Proteine: Sono formate da lunghe catene amminoacidiche. Queste catene possono assumere conformazioni diverse, così che si hanno quattro livelli di struttura: Struttura primaria delle proteine, costituita dalla sequenza degli amminoacidi nella catena Struttura secondaria delle proteine, costituita dalla conformazione ordinata che i vari segmenti della catena possono assumere Struttura terziaria delle proteine, data dai ripiegamenti che le varie proteine assumono per generare la loro forma Struttura quaternaria, che descrive come le varie subunità che eventualmente costituiscono la proteina si assemblano fra loro Determinazione della struttura primaria di peptidi e proteine • Identificazione degli amminoacidi presenti • Identificazione della quantità degli amminoacidi presenti • Identificazione della sequenza degli amminoacidi presenti Identificazione della composizione amminoacidica di un peptide: si effettua attraverso reazioni di degradazione • Scissione dei ponti disolfuro (reazione di riduzione) • Scissione dei legami peptidici (a 110°C in HCl acquoso: idrolisi dei legami ammidici) L’analisi della miscela di amminoacidi ottenuta dall’idrolisi si effettua tramite cromatografia (HPLC), o gascromatografia, dopo averli trasformati in esteri metilici Identificazione dell’amminoacido N-terminale: degradazione di EDMAN Consente di scindere selettivamente l'amminoacido N-terminale, lasciando il polipeptide accorciato di un'unità. Il reattivo di Edman è il fenilisotiocianato, che trasforma l'amminoacido N-terminale in una tiourea ciclica. tiourea ciclica con il suo gruppo R identificabile Meccanismo : Vantaggio: lascia intatta la restante catena peptidica, così l’analisi può essere ripetuta. Identificazione dell’amminoacido N-terminale: degradazione di SANGER Utilizza il reattivo di Sanger : 2,4-dinitrofluorobenzene (2,4D) Dopo aver marcato il peptide con il reattivo di Sanger, si idrolizza in ambiente acido ottenendo l’amminoacido N terminale marcato dal 2,4 D, che viene separato e identificato Identificazione dell’amminoacido C-terminale L'identificazione dell'amminoacido C-terminale di una sequenza amminoacidica viene effettuata impiegando un enzima, la carbossipeptidasi, in grado di idrolizzare il legame peptidico a partire esclusivamente dall'unità C-terminale
Scaricare