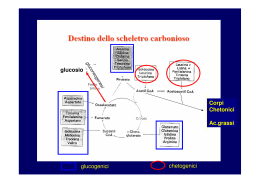
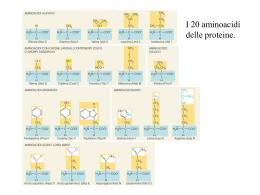
Le macromolecole organiche •Lipidi •Glucidi •Proteine •Acidi nucleici Esistono decine di migliaia di diverse proteine. In ciascun essere vivente esse svolgono funzioni fondamentali che nessun altro tipo di molecola potrebbe svolgere Nella cellula catalizzano migliaia di differenti reazioni chimiche (Enzimi) Trasportano specifiche molecole sia nelle cellule che nei fluidi esterni Regolano lo sviluppo e orchestrano il funzionamento dell’intera cellula Fungono da messaggeri chimici (Ormoni e neurotrasmettitori) Permettono il passaggio selettivo di molecole attraverso la membrana (Canali Ionici e Pompe) Attaccano selettivamente gli agenti esterni (anticorpi del S.I.) Hanno funzione strutturale sia all’interno della cellula (citoscheletro) che al di fuori (es cheratine) Presiedono al movimento sia all’interno della cellula (cilia, trasporto assoplasmatico) che a livello di sistema (es lavoro muscolare) Proteine Struttura chimica delle proteine Ciascuna proteina è un polimero costituito da una serie di componenti di base, gli aminoacidi legati tra loro Sono praticamente gli stessi in tutti i viventi Esistono circa 20 diversi aminoacidi legati tra loro con un legame (che si chiama legame peptidico) Ciascuna proteina e costituita da un numero variabile di aminoacidi. Le più piccole sono costituite da pochi aminoacidi (in reltà quelle più piccole vengono chiamate polipeptidi) Arginina valina triptofano Lisina Alanina valina Prolina triptofano valina Le più grandi possono essere costituite anche da 5.000 aminoacidi Proteine Ciascuno dei 20 aminoacidi ha: una parte comune agli altri e una parte che è specifica per quell’aminoacido H NH2-C-COOH R È la porzione dell’aminoacido che serve a formare il legame peptidico (con gli altri aminoacidi) Residuo aminoacidico Chiamato anche con i termini: Catena laterale Gruppo R Il residuo aminacidico nei 20 aminoacidi differisce per il numero di atomi di C e per la presenza di gruppi funzionali Esso fornisce proprietà diversa a ciascuno dei 20 aminoacidi I venti aminoacidi differiscono tra loro in quanto: • I residui sono carichi oppure elettricamente neutri • I primi possono avere carica positiva o negativa • Alcuni hanno residui idrofobici mentre altri hanno residui polari • I residui hanno ingombri molto diversi • Alcuni residui hanno gruppi funzionali peculiari Questa differenza nelle caratteristiche dei Residui Aminoacidici determina sia la struttura tridimensionale della proteina che le sue funzionalità I venti aminoacidi Elettricamente carichi L’acido glutammico o glutammato è anche uno dei più diffusi neurotrasmettitori (eccitatorio) Proteine Polari ma non carichi Aminoacidi particolari Idrofobici La glicina è un importante neurotrasmettitore inibitorio La tirosina è il precursore delle catecolamine, Il triptofano è il precursore della serotonina, un importante NT importanti neurotrasmettitori e ormoni (Dopamina, noradrenalina, e adrenalina) Proteine Il legame peptidico La porzione comune ad ogni aminoacido è costituita da un C cui sono legati il gruppo R, un idrogeno e due gruppi funzionali: un gruppo aminico NH2 H NH2-C-COOH un gruppo carbossilico COOH R Il legame peptidico è un legame covalente e si forma tra il gruppo aminico NH2 di un aminoacido e il gruppo carbossilico COOH dell’altro H NH2-C-COOH R H NH2-C-COOH R Proteine R R R R Proteine
Scaricare