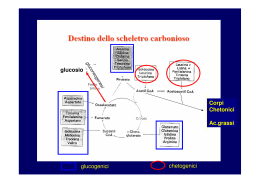
I 20 aminoacidi delle proteine. Modificazioni covalenti delle catene laterale degli aminoacidi. NB: R-OH ⇆ R-O-Pi Ser-O-Pi Thr-O-Pi Tyr-O-Pi R-Ⓟ Importanti derivati degli aminoacidi. Proprietà degli aminoacidi presente nelle proteine pKa α-COOH Alanina 2.3 Arginina 2.2 Asparagina 2.0 Acido aspartico 2.1 Cisteina 1.8 Glutamina 2.2 Acido glutammico 2.2 Glicina 2.3 Istidina 1.8 Isoleucina 2.4 Leucina 2.4 Lisina 2.2 Metionina 2.3 Fenilalanina 1.8 Prolina 2.0 Serina 2.2 Treonina 2.6 Triptofano 2.4 Tirosina 2.2 Valina 2.3 pKa pKa α-NH3+ catena lat. 9.7 9.0 12.5 8.8 9.8 3.9 10.8 8.3 9.1 9.7 4.2 9.6 9.2 6.0 9.7 9.6 9.0 10.0 9.2 9.1 10.6 9.2 10.4 9.4 9.1 10.1 9.6 - massa (dalton) 71 156 114 115 103 128 129 57 137 113 113 128 131 147 97 87 101 186 163 99 frequenza (mol %) 9.0 4.7 4.4 5.5 2.8 3.9 6.2 7.5 2.1 4.6 7.5 7.0 1.7 3.5 4.6 7.1 6.0 1.1 3.5 6.9 Ossidazione della cisteina: la possibilità di formare un legame disolfuro (ponte disolfuro). Cys-SH Cys-S―S-Cys Sequenza dell’insulina bovina Ponte disolfuro: intercatena intracatena Struttura delle proteine: I quattro livelli. La struttura Primaria: la sequenza degli aminoacidi (della catena lineare) Ogni proteina ha una sequenza unica e precisamente definita La struttura Secondaria: schemi regolari di ripiegamento della catena α-elica, foglietto β, etc. La struttura Terziaria: la struttura tridimensionale di un intero polipeptide Proteine composte da due o più polipeptidi (subunità): La struttura Quaternaria: la disposizione spaziale delle subunità Il legame peptidico (ammidico): -CO─NHparziale carattere di doppio legame (planare, rigido) normalmente conformazione trans (ingombro sterico) Struttura primaria Struttura secondaria: foglietto β Stabilizzato tramite legami idrogeno tra le catene Due possibilità: (a) parallelo (b) antiparallelo Foglietto β Forma più o meno piatta o pieghettato (ondeggiante) Quasi sempre una certa distorzione (avvolgimento) lungo l’asse delle catene Un foglietto β contiene da 2 a 12 catene (media intorno a 6) Ogni catena contiene fino a 15 aminoacidi (media 6) Esempio di foglietto β (A) Modello molecolare (B) Modello schematico (C) Modello B rotato 90° Struttura secondaria: α-elica Stabilizzato tramite legami idrogeno dentro la catena 3,6 residui per giro (passo = 3,6) in giallo: residui laterali Proteine fibrose: ruoli strutturali in cellule e tessuti animali miosina (muscoli) fibrina (coaguli di sangue) α-cheratina (capelli) collageno (tendine, tessuto connettivo, cartilagine) β-cheratina (piume, scaglie) fibroina (seta) elastina (tessuto estensibile, legamenti, vasi sanguigni) α-Eliche avvolte (superavvolte). La lunghezza può superare 100 nm (0.1 µm) α-Cheratina Nei capelli esposti a acqua calda (vapore) le α-cheratine cambiano strutture, diventano una forma β estesa. Con un composto riducente è possibile aprire i ponti disolfuro, piegare i capelli, e riossidare le cisteine creando ponti disolfuro in posizioni nuovi. I legami covalenti mantengono la piega dei capelli in modo permanente. Fibroina: fibre della seta (baco da seta, ragni) (Ser-Gly-Ala-Gly-Ala-Gly)n Filiera di ragno Collageno non è un α-elica. Sequenza: -(Gly-Xxx-Pro)- oppure -(Gly-Xxx-Hyp)Solo 3 residui per giro; tre catene superavvolte Fibre di collageno Proteine globulari. Mioglobina. Mioglobina: aminoacidi polari (viola) aminoacidi idrofobici (giallo) aminoacidi neutro (bianco) Proteine globulari: (a) Una subunità dell’emoglobina (b) Concanavalin A di fagiolo (c) Trioso fosfato isomerasi Motivi proteici: βαβ Ripiegamento a forcina β Barile β Barile β αα Barile α/β Gliceraldeide-3-fosfato deidrogenasi: due domini distinti (una subunità) Prioni: 253 aminoacidi PrPC - prion protein "cellular" PrPSc - prion protein "scrapie". PrPC PrPSc Animal forms: Scrapie BSE Transmissible mink encephalopathy (TME) chronic wasting disease Feline spongiform encephalopathy (FSE) Human forms: kuru Creutzfeldt-Jakob disease (CJD) Gerstmann-Straussler syndrome (GSS) fatal familial insomnia (FFI) EMOGLOBINA
Scaricare