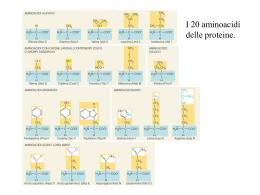
Biochimica Strutturale Mauro Fasano [email protected] Argomenti del corso 1) Proprietà chimico-fisiche degli aminoacidi 2) Organizzazione strutturale delle proteine 3) Purificazione e caratterizzazione delle proteine 4) Determinazione della struttura delle proteine 5) Classificazione strutturale delle proteine e principali motivi strutturali 6) Strutture quaternarie e cooperatività 7) Enzimi 8) Proteine del sistema immunitario 9) Patologie associate a misfolding proteico 10) Motivi strutturali del DNA Testi consigliati • GA Petsko, D Ringe, Struttura e funzione delle proteine, Zanichelli 2006. • Reviews consigliate nel corso • Elementi di base: DL Nelson, MM Cox, I principi di biochimica di Lehninger, 2010 Modalità di esame • Orale con una domanda generale e una specifica • 6 Appelli nelle pause didattiche Proprietà chimico-fisiche degli aminoacidi Aminoacidi • Aminoacidi proteici – Monomeri delle proteine – Liberi • Aminoacidi non proteici Struttura degli aminoacidi Proprietà fisiche degli aminoacidi Caratteristiche ioniche: Punto di fusione (decomposizione) alto (>200°C) Solubili in acqua e non in solventi apolari Alta costante dielettrica e forte momento dipolare La solubilità in acqua aumenta a pH acidi o basici Chiralità degli aminoacidi Proprietà ottiche degli aminoacidi Proprietà ottiche degli aminoacidi Spettri di assorbimento Gli aminoacidi proteici Gli aminoacidi proteici Gli aminoacidi proteici Gli aminoacidi proteici Gli aminoacidi proteici Gli aminoacidi proteici Gli aminoacidi proteici Gli aminoacidi proteici Proprietà acido-base • • • • Tutti gli aminoacidi hanno un gruppo –COOH Tutti gli aminoacidi hanno un gruppo –NH3 Alcune catene laterali hanno un gruppo acido Alcune catene laterali hanno un gruppo basico Punto isoelettrico • Valore medio delle pKa dei gruppi ionizzabili Proprietà acido-base I gruppi α-COOH ed α–NH2 si influenzano reciprocamente: –NH2 (elettronegativo) aumenta l’acidità di α-COOH (pKa = 2.0 –2.2 vs 4.7 dell’acido acetico) -COOH (elettronegativo) aumenta l’acidità di α-NH3+ (pKa = 9.2 – 9.6 vs 10.6 di metilammina) Henderson-Hasselbach pH = pKa + log (CB/CA) Titolazione della glicina pH = pKa + log (CB/CA) pI = 1/2 (pKi + pKj) pH = pKa + log (CB/CA) Titolazione dell’alanina Titolazione dell’aspartato pI = 1/3 (pKα + pKγ + pKNH3) Titolazione dell’arginina pI = 1/3 (pKCOOH + pKNH3 + pKguan) Titolazione dell’istidina pI = 1/3 (pKCOOH + pKNH3 + pKim) Punti isoelettrici degli aminoacidi polifunzionali Amino Acid α-COOH α-NH3 pKa1 pKa2 Side Chain pKa3 pI Arginine 2.00 9.00 13.20 11.15 Aspartic Acid 2.01 9.82 3.83 2.80 Cysteine 1.71 10.78 8.33 5.02 Glutamic Acid 2.19 9.67 4.25 3.22 Histidine 1.82 9.17 6.04 7.59 Lysine 2.17 9.00 10.80 9.65 Tyrosine 2.20 9.11 10.07 5.66 Isoelettrofocalizzazione degli aminoacidi Idrofilicità Separazione cromatografica basata sulla diversa polarità degli aminoacidi Interazioni non-covalenti tra aminoacidi Interazioni non-covalenti tra aminoacidi • Covalente • Non covalente: – – – – ioniche legame idrogeno dipolo-dipolo London > 300 kJ/mol 80 - 90 20 8 - 10 <1 Amino acidi essenziali • Essenziali (n. 8): Trp, Lys, Met, Phe, Thr, Val, Leu, Ile Aminoacidi non proteici • Aminoacidi modificati • Altri
Scaricare