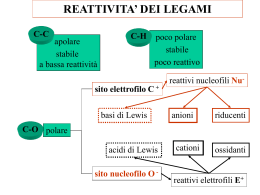
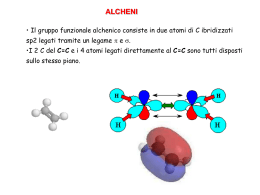
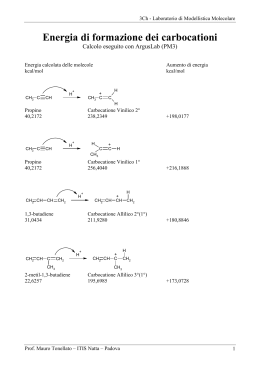
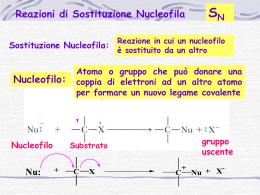
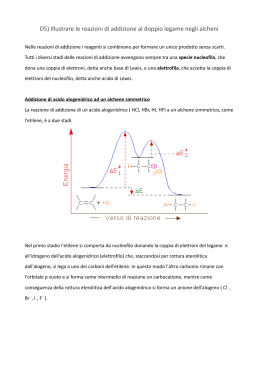
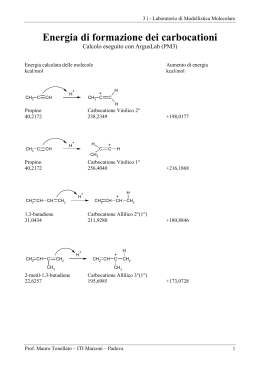
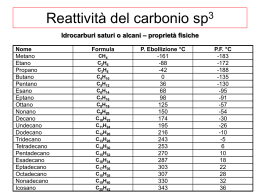
Alogeno derivati Composti contenenti un atomo di alogeno covalentemente legato ad un atomo di carbonio ibridato sp3. : R-X: : X = F, Cl, Br, I H Cl H Cl C Cl H Diclorometano C H Cl Cl C Cl Cl Tetraclorometano (tetracloruro di carbonio) H Clorometano (cloruro di metile) H Cl C Cl Cl Triclorometano (cloroformio) Clorofluorocarburi (CFC) Cl Cl C Cl F triclorofluorometano (freon 11) F Cl Cl C F F diclorodifluorometano (freon 12) Cl C H Cl diclorofluorometano (freon 21) N.B. il cloro non si consuma a seguito della reazione complessiva, quindi ha un ruolo catalitico Sangue artificiale F F F F F F F F F F F F F F F F F F Trans perfluorodecalina CF2CF2CF3 CF3CF2CF2 N CF2CF2CF3 Perfluorotributilammina CF3-CF2-CF2-CF2-CF2-CF2-CF2-CF2Br 1-bromoperfluoroottano F F Cl C H F C H Cl H Br 1-cloro-1-bromo-2-trifluoroetano (alotano) H C H Cl C H H cloroetano (cloruro di etile) C C Cl Cl tricloroetene (trielina) Reazione di sostituzione nucleofila Nu:- + SN C X C Nu + :X- Avviene secondo 2 distinte modalità indicate come: SN1 e SN2 a seconda dell’ordine di reazione II I - + - Questo è lo stadio e quindi è una lento HO- H H C Cl H H - Cl- H HO C H HO C Cl stadio veloce H H H La reazione decorre in due stadi: nel primo stadio il nucleofilo OH- attacca il carbonio a cui è legato l’atomo di cloro dalla parte opposta a quella dove si trova il cloro nella seconda fase, il complesso attivato perde uno ione ClHO- C2H5 H C Cl CH3 stadio lento - C2H5 HO C Cl H CH3 Cl- C2H5 HO C H stadio veloce CH3 il meccanismo SN2 seguito dalla reazione comporta inversione di configurazione del carbonio asimmetrico H - HO C Cl H H energia intermedio di transizione v = K [OH-][CH3Cl] Reazione di 2° ordine reagenti HO- H prodotti H C Cl H H HO C H Coordinate di reazione H Cl- I quattro sostituenti sono diversi !!! Et Et I - Cl Me Rectus II + ClMe Sinister SN2 animazione Le reazioni di sostituzione nucleofila degli alogeno-derivati terziari decorrono con cinetica di 1° ordine, perché la fase più lenta del processo (formazione del carbocatione) Cl- R3 R3 + R1 R2 Cl R1 non coinvolge il nucleofilo entrante R2 Nella prima tappa l’alogeno-derivato terziario perde lo ione alogenuro Cl- R3 R3 + R1 R2 Cl R1 R2 Successivamente (nella prossima trasparenza), il nucleofilo OH- attacca il carbocatione indifferentemente dal lato destro o sinistro del piano di ibridazione. Da ciò consegue che il prodotto di reazione è una miscela racemica dei due enantiomeri. R3 R3 + R1 R2 R2 R1 Miscela racemica R3 R3 + R1 R2 R1 R2 v = K [(C(CH3)3Br] Reazione di 1° ordine SN1 animazione Il destino di una sostituzione nucleofila è controllato da: • fattori elettronici (stabilità del carbocatione, caratteristiche del solvente) • fattori sterici (ingombro dei sostituenti) Reazione di eliminazione H Nu:- + C E C X C=C + NuH + X: Avviene secondo 2 distinte modalità indicate come: E1 e E2 a seconda dell’ordine di reazione Reazione di eliminazione E1 Lo ione OH- strappa un protone dalla posizione a contestualmente, il bromo esce come ione bromuro Fra i carboni 1 e 2 si contrae un legame p Reazione di eliminazione E2 : H HO - H H C C C H H C H Br Stadio lento H H H H H H 2O + Br H H H C H C H C C C H H H C C H H H C H H H E2 animazione
Scaricare