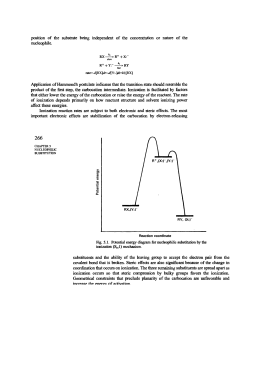
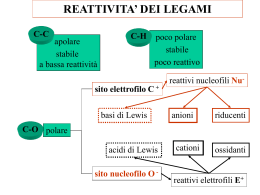
Reazioni di Sostituzione Nucleofila Sostituzione Nucleofila: Nucleofilo: Nucleofilo Nu: Reazione in cui un nucleofilo è sostituito da un altro Atomo o gruppo che può donare una coppia di elettroni ad un altro atomo per formare un nuovo legame covalente gruppo uscente Substrato + SN C X C + + X Nu Nucleofilo + CH3Br Prodotto I nucleofili sono Basi di Lewis Non tutte le basi possono essere dei buoni nucleofili! R - - SR R SR tioetere - SH R tiolo SH X - OH R OH alcool R OR etere HPR2 NH3 OR R NH2 ammina R PR2 fosfina Meccanismo della Sostituzione Nucleofila Bimolecolare Meccanismo SN2 Il nucleofilo attacca il C dal lato opposto al gruppo uscente δ+ Il nucleofilo reagisce con il carbonio elettrofilo Stato di transizione con due reagenti e con simultanea rottura e formazione di legame Una reazione SN2 conduce ad una inversione della configurazione Diagramma dell’ Energia potenziale in una SN2 Meccanismo SN1 Sostituzione nucleofila monomolecolare Stadio 1 : scissione eterolitica del legame C-X lento Un solo reagente nello stadio lento: monomolecolare Stadio 2: il nucleofilo reagisce con il carbocatione su i due lati possibili Stadio 3: trasferimento di protone (eq. Acido-base) Diagramma dell’ Energia potenziale in una Stadio 1 Stadio 2 SN1 Una reazione SN1 quando è condotta su uno stereocentro tetraedrico (carbonio chirale), conduce ad una miscela racemica S Enantiomero R Carbocatione (planare) R Miscela racemica Figura 11.11 Stereochimica della reazione SN1. Dal momento che la razione procede attraverso un intermedio achirale, un reagente enantiomericamente puro viene trasformato in una miscela racemica. Dal volume: McMurry “Chimica organica” Piccin Nuova Libraria S.p.A. Etanolo Dal volume: McMurry “Chimica organica” Piccin Nuova Libraria S.p.A. Figura 11.12 L’ipotesi della coppia ionica nelle reazioni SN1. Il gruppo uscente ostacola da un lato l’accesso del nucleofilo al carbocatione intermedio, portando così ad una parziale inversione di configurazione anziché alla completa racemizzazione. Dal volume: McMurry “Chimica organica” Piccin Nuova Libraria S.p.A. Fattori che influenzano le velocità della reazioni SN1 e SN2 A) Struttura del Nucleofilo B) Struttura dell’alogenuro alchilico C) Struttura del gruppo uscente D) Effetto del tipo di solvente usato A) Struttura del Nucleofilo (influenza la sua nucleofilicità) Efficacia come nucleofilo nucleofilo buono medio scarso B) Struttura del substrato Le reazioni SN1 sono governate da fattori elettronici Le reazioni SN2 sono governate da fattori sterici 2-bromo-2-metilbutano bromometano nucleofilo nucleofilo Attacco sfavorito per ingombro sterico Effetto dei fattori sterici ed elettronici tra SN1 e SN2 Stabilità crescente del carbocatione Facilità di accesso al sito di reazione C) Struttura del gruppo uscente Reattività come gruppo uscente Stabilità dell’anione, forza dell’acido coniugato Buoni gruppi uscenti sono le basi deboli! D) Effetto del tipo di solvente usato (protico od aprotico) Solvente protico: solvente donatore di legami idrogeno (acqua, etanolo, ac. acetico) Solvente Acqua ac.formico metanolo etanolo ac. acetico Polarità Questi solventi favoriscono la SN1. Maggiore è la polarità più facilmente si forma il carbocatione Solvente aprotico: solvente che non può fungere da donatore di legami idrogeno Solvente Dimetilsofossido (DMSO) Acetone Diclorometano Etere dietilico Polarità Questi solventi favoriscono la SN2, esaltano il carattere nucleofilo degli anioni. Confronto tra SN2 e SN1 Struttura alogenuro SN2 SN1 Primario comune Rara(ecc.allilici, benzilici) Secondario osservata osservata Terziario rara comune Stereochimica inversione racemizzazione Solvente Ritardata polari protici, Aumentata polari aprotici Aumenta con polarità solventi Nucleofilo Velocità dipendente dalla concentrazione nucleofilo, meglio se anione Velocità indipendente dalla concentrazione del nucleofilo, meglio se neutro La preparazione degli alogenuri alchilici a partire dagli alcoli ROH + HX RX + H2O (X = Cl, Br, or I) La reazione di HX con un alcol terziario è talmente veloce che si effettua spesso semplicemente facendo gorgogliare il gas HX puro nella soluzione eterea fredda dell'alcol. Il processo si completa di solito in pochi minuti. Il miglior modo di trasformare in alogenuri alchilici gli alcoli primari e secondari è quello di trattarli con reagenti come il doruro di tionile (SOCl2) o il tribromuro di fosforo (PBr3). Queste reazioni, che normalmente hanno luogo facilmente in condizioni blande, comportano un ambiente meno acido e sono meno suscettibili del metodo ad HX di causare la trasposizione catalizzata dagli acidi. O O R CH2OH + Cl S Cl R CH2O + Cl R CH2Cl S Cl + HCl O R CH2O S Cl + SO2 + HCl L'alchilazione degli ioni acetiluro Grazie al suo carattere del tutto generale, l'alchilazione degli acetiluri costituisce il metodo migliore per preparare gli alchini sostituiti a partire da precursori più semplici. Quelli terminali si preparano dall'acetilene propriamente detto, quelli interni si ottengono per ulteriore alchilazione dell'idoneo alchino terminale. L'anione acetiluro nucleofilo utilizza la sua coppia solitaria di elettroni per formare un legame verso l'atomo di carbonio del bromometano, polarizzato in senso positivo. Mentre nello stato di transizione incomincia a prender corpo il nuovo legame C-C, incomincia anche a scindersi il legame C- Br. Al termine della reazione il nuovo legame C- C si è completamente formato e il vecchio legame C- Br si è completamente scisso. Composti organomagnesiaci (reattivi di Grignard) 1-clorobutano Cloruro di butilmagnesio La differenza di elettronegatività tra il C e il Mg è 1.3; il legame è fortemente polarizzato Carattere di CARBANIONE (un C nucleofilo) I reattivi di Grignard sono anche basi molto forti (l’atomo basico è il carbonio) Base più forte Acido più forte Acido più debole Base più debole Riescono a cedere un protone al reattivo di Grignard Addizione all’ossido di etilene Alcol primario Reazioni di Sostituzione nucleofila in sistemi biologici
Scaricare