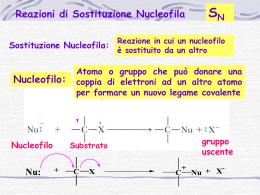
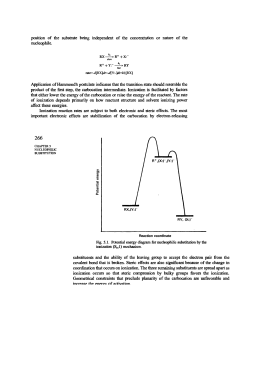
Alogenuri Alchilici R-Cl R-Br R -I R-F Alogenoalcani • I composti contenenti un atomo di alogeno legato covalentemente ad un atomo di carbonio ibridato sp3 sono chiamati alogenoalcani o alogenuri alchilici. alchilici • Il simbolo generale per un alogenuro alchilico è R-X dove X può essere Fluoro, Cloro, Bromo o Iodio R- F R-Cl R- X R-Br R-I Nomenclatura • Nella nomenclatura IUPAC l’atomo di alogeno viene visto come un sostituente dell’alcano. Br CH3CH2 I 1-iodoetano ioduro di etile 2-bromobutano bromuro di isobutile • La nomenclatura comune identifica i più semplici come alogenuri di alchile considerando le catene alchiliche come sostituenti degli acidi alogenidrici Tipi di alogenuri • Anche per gli alogenuri si usa la denominazione metilico, primario, secondario e terziario a seconda del tipo di atomo di carbonio legato all’atomo di alogeno R R C X R alogenuro terziario R R C X H alogenuro secondario R C X H2 alogenuro primario H3C X alogenuro metilico Proprietà • Il legame C-X è polarizzato: – A causa della maggiore elettronegatività degli alogeni rispetto al carbonio. – L’atomo di alogeno possiede una parziale carica negativa (δ-) e l’atomo di carbonio una parziale carica positiva (δ+). Proprietà • Gli alogenoalcani hanno punti di ebollizione maggiori rispetto ai corrispondenti alcani. – Questo a causa alle interazioni dipolo-dipolo che si vengono a creare tra le molecole degli alogenoalcani. – All’aumentare della grandezza dell’alogeno aumentano anche le interazioni molecolari – Gli atomi più grandi sono infatti più polarizzabili Reattività • L’atomo di carbonio polarizzato positivamente è elettrofilo ed è soggetto all’attacco da parte di anioni ed altre specie nucleofile. nucleofile Nu • Il nucleofilo sostituirà l'atomo di alogeno Sostituzione nucleofila • Nella descrizione della reazione, il reagente organico (alogenuro) viene detto substrato. substrato • L'attacco del nucleofilo promuoverà il distacco dell’atomo di alogeno che si porterà via gli elettroni di legame. • Il risultato sarà la sostituzione dell’atomo di alogeno, che viene detto gruppo uscente, uscente con il nucleofilo. Nu- + R X δ+ δ− Nu R + X- Sostituzione nucleofila • I nucleofili possono essere carichi negativamente come :OHNu- + Nucleofilo R X Nu R + X- Gruppo Uscente Substrato • o neutri, come :NH3 e in questo caso di nucleofili neutri la reazione terminerà con l’espulsione di un protone HNu: + Nucleofilo R X Substrato + HNu R + X- Gruppo Uscente Nu R + H+ Sostituzione nucleofila • A seconda del tipo di nucleofilo usato si possono formare prodotti diversi Nucleofilo Prodotto -OH R-OH Alcool -OR’ R-OR’ Etere -SR’ R-SR’ Solfuro CI- R-CI Cloruro alchilico Br- R-Br Bromuro alchilico NH3 R-+NH3 ⇆ RNH2 + H+ Ammina Sostituzione nucleofila • Il meccanismo della reazione dipende da vari fattori come il tipo di substrato, substrato il tipo di nucleofilo, nucleofilo il tipo di gruppo uscente ed il tipo di solvente usati. • I due meccanismi con i quali può avvenire tale reazione prendono il nome di SN2 e SN1 dove SN sta per sostituzione nucleofila SostituzioneNucleofila Bimol.MOV Meccanismo SN2 • Nel meccanismo SN2 la reazione avviene in un unico stadio: stadio HO- H H H C Br δ− δ+ H H δ− HO C Br δ− H # H HO C H + Br- H • Il nucleofilo attacca il substrato polarizzato dalla parte opposta del gruppo uscente forzando ad uscire l’atomo di alogeno che se ne va portando con sé gli elettroni di legame. • Nello stato di transizione il legame Nu-C è parzialmente formato e quello C-X è parzialmente rotto e la carica negativa è suddivisa tra i due gruppi, entrante ed uscente. • Al termine si la completa formazione del legame Nu-C e la completa rottura di quello C-X. Meccanismo SN2 • La sigla SN2 sta ad indicare che la reazione una Sostituzione Nucleofila Bimolecolare. Bimolecolare • Nello stadio fondamentale della reazione infatti ci sono due specie (Substrato e Nucleofilo) che partecipano alla reazione. • Poiché la reazione avviene in un unico stadio la velocità di reazione dipende sia dalla concentrazione del substrato che dalla concentrazione del nucleofilo e l’equazione cinetica è del 2° ordine globale e del 1° ordine rispetto ad ognuno di essi. v = k [R-Br ] ⎡⎣OH- ⎤⎦ Diagramma energetico Punto di attacco • Una reazione SN2 è spinta dall'attrazione tra la carica negativa del nucleofilo (in questo caso l'ossigeno carico negativamente dello ione idrossido) e il centro di carica positiva dell'elettrofilo (in questo caso la carica parziale positiva sul carbonio legato al cloro che funge da gruppo uscente). Punto di attacco Tipo di substrato • Gli alogeno metani (CH3-X) sono i substrati più reattivi, seguiti dagli alogenuri primari (RCH2-X). La reazione è molto più lenta per gli alogenuri secondari (R2CH-X) e ancor di più per i terziari (R3C-X). • Questo a causa della diminuzione di accessibilità dell’atomo di carbonio che subisce l’attacco del nucleofilo all’aumentare del numero di gruppi alchilici legati ad esso. Ingombro sterico • All'aumentare dell'ingombro dei sostituenti legati al carbonio che sta subendo l'attacco nucleofilo diminuisce la possibilità di accedere al retro del carbonio, con conseguente diminuzione della velocità della reazione SN2. SN2QT4.MOV SN2.MOV SN2Octane.xyz Decorso stereochimico • Nel caso in cui il substrato sia chirale: HO H3C H3C # H C Br CH2 H3C H HO C Br CH2 CH3 CH3 H3C C C Br H2 H R H CH3 + Br HO C H2C CH3 CH3 HO C C CH3 H2 H S La reazione avviene con inversione di configurazione in quanto il nucleofilo attacca il substrato dalla parte opposta rispetto al gruppo uscente Esempio H Cl + OH* Cl Me HO H + Cl* H Et H Reagente (R) Me OH Et Et OH Me H Prodotto (S) Esempio CH3SO3 H Ph D H I bz bz D OSO2CH3 Reagente (S) D H + CH3SO3* Ph OSO2CH3 H D + I* I D bz H Prodotto (R) Meccanismo SN1 • Nel meccanismo SN1 la reazione avviene in due stadi: stadi R Nu- R C X + Rδ δ− lento R R R C+ R Nu C veloce R + X- R • Nel primo stadio lento, il gruppo uscente si stacca portandosi via gli elettroni di legame e generando un intermedio carbocatione planare (sp2) • Nel secondo stadio veloce, il nucleofilo reagisce con il carbocatione portando alla formazione del prodotto di sostituzione Meccanismo SN2 • La sigla SN1 sta ad indicare che la reazione una Sostituzione Nucleofila Monomolecolare. Monomolecolare • Allo stadio fondamentale (LENTO) della reazione infatti partecipa solamente il Substrato che si dissocia per formare l’intermedio carbocatione. • La velocità di reazione dipende solo dallo stadio lento e quindi solo dalla concentrazione del substrato: l’equazione cinetica è del 1° ordine rispetto ad esso. v = k [R-Cl] Diagramma energetico Ea2 C) Ea1 + Cl- + OH- Tipo di substrato • Il processo monomolecolare è veloce su Substrati terziari, benzilici e allilici che danno carbocationi stabili mentre è lenta su substrati secondari; i substrati primari che non possono dare carbocationi stabili reagiscono preferenzialmente via SN2 SN1rSN1r-SN1sk Decorso stereochimico • Nel caso il substrato sia asimmetrico, si ha la produzione di un prodotto racemo perché il carbocatione intermedio è planare e può subire l’attacco da entrambi i lati Esempio Quali di questi bromoalcani vi aspettate reagisca via SN1 più velocemente ? Br Br Differenza • La differenza sostanziale tra una reazione di sostituzione che segua un meccanismo SN2 piuttosto che un meccanismo SN1 è che: • la SN2 procede in un unico stadio attraverso uno stato di transizione • la SN1 procede in due stadi, attraverso un intermedio carbocatione SOSITUZIONI NUCLEOFILE Confronto Tipo di substrato H H H X R R X H H Metilico Primario R R X H Secondario R X R Terziario I substrati metilici, primari e terziari reagiscono più velocemente. I substrati metilici, primari e molti secondari reagiscono con il meccanismo SN2 I substrati terziari, ed alcuni secondari attraverso il meccanismo SN1 Nucleofili Anioni: I-, Br-, Cl-, F-, OH-, RO-, RS-, R3C-, RCOOMolecole Neutre: R3N, R3P, H2O Nucleofilo Reagente Sostituente Finale Br- HBr -Br Cl- HCl -Cl I- HI -I H2O -OH OH- NaOH -OH RO- NaOR -OR CN- NaCN, KCN -CN NH3, NR3 -NH2, -NR2 Le SN2 sono favorite da nucleofili anionici Sostituzione nucleofila La reazione avviene anche su altri substrati che portino dei gruppi elettronegativi su catene alchiliche come gli alcoli, alcoli gli eteri, eteri i tioli. tioli δ+ δ− R OH Alcol δ+ δ− R OR' Etere δ− δ+ R SH Tiolo La presenza di buoni gruppi uscenti sposta il meccanismo a favore della SN1 in quanto sarà più facile che avvenga la ionizzazione del substrato Effetto solvente • I solventi polari protici stabilizzano i composti polari ed eventuali ioni che si possono formare nel corso della reazione – stabilizzano il gruppo uscente; – stabilizzano il carbocatione che si forma durante il meccanismo monomolecolare facilitando la dissociazione del substrato; – stabilizzano il nucleofilo diminuendone la reattività, in quanto possono protonarlo o semplicemente solvatarlo • Aumentando la polarità del solvente e la sua abilità solvatante, il meccanismo si sposta verso la SN1. Il processo SN2 è favorito • Substrati poco ingombrati. – Su substrati Metilici (CH3X) e Primari (RCH2X) – Su substrati Secondari (R2CHX) solo con nucleofili forti – Mai su substrati Terziari (R3CX) • Uso di nucleofili forti, anionici. • Uso di solventi apolari che non favoriscono la formazione del carbocatione Il processo SN1 è favorito • Substrati che portano alla formazione di carbocationi stabili. – Su substrati Terziari (R3CX) – Su substrati Secondari (R2CHX) con nucleofili deboli • Uso di nucleofili deboli, spesso neutri. – Spesso il nucleofilo è lo stesso solvente, come l’acqua, gli alcoli e gli acidi carbossilici • Uso di solventi polari protici che stabilizzano il carbocatione intermedio, il nucleofilo (disattivando l’attacco via SN2) ed il gruppo uscente. Esempio Quali sono i due prodotti di sostituzione attesi in questa reazione ? Br NH2 (1eq) NaOH OH H N Eliminazioni Nucleofile Eliminazione ad alchene • Un alogenoalcano che abbia in β all’atomo di alogeno un atomo di idrogeno, può reagire con un nucleofilo (che può anche funzionare da base) anche in modo diverso e cioè eliminando acido alogenidrico e formando un alchene. alchene • Si ha la perdita di H e X da atomi adiacenti e viene quindi definita: 1,2- o α,β-eliminazione. • E’ uno dei principali metodi per la sintesi di alcheni • Questa reazione è in competizione con la sostituzione nucleofila. α H H3C CH CH CH3 X β + YH3C CH CH CH3 + HY + X- Meccanismi • Anche l’eliminazione può avvenire con due meccanismi diversi: H C C X H2 H2 B -BH) H -X* H H E2 H Eliminazione bimolecolare R H C C X H2 R -X* lento ) H C C R H2 R B -BH) veloce H R E1 H Eliminazione monomolecolare R Meccanismo E2 • Il meccanismo E2 è un meccanismo concertato in cui il nucleofilo agisce da base e strappa un protone aiutando l’uscita dell’alogenuro H CH2 C X H2 :B -BH) H H -X* H H v = k [R − X][B] • E’ favorita da una forte basicità del reagente e dalla bassa polarità del solvente – I solventi polari solvatano e quindi inattivano la base Meccanismo E1 R H C C X H2 R -X* lento ) H C C R H2 R B -BH) veloce H R H R v = k [R − X] • E’ un processo che avviene in due stadi • Il primo stadio della E1 è lo stesso della SN1 e porta alla formazione dello stesso carbocatione intermedio • Questo nelle eliminazioni si stabilizza espellendo un protone e formando un legame π anziché addizionando il nucleofilo • Si formano sempre miscele di prodotti (di sostituzione e di eliminazione) Regiochimica H H CH2CH3 - HBr 6% H (2) (2) Br H3C C CH3 H2 H - HBr (1) H (1) H3C CH3 94% H In entrambi i casi si forma l’alchene più stabile e cioè il più sostituito o quello delocalizzato Br CH2CH3 - HBr H 87% H (2) (2) C H2 C CH3 H2 H (1) - HBr (1) H H2C CH3 H 13% Eliminazione vs.Sostituzione • In presenza di alogenuri alchilici che reagiscono con nucleofili si ha sempre competizione fra sostituzione ed eliminazione che possono avvenire con due meccanismi diversi Me Br E1/SN1 H Me C CMe2 - Br* H HO* H ) Me C CMe2 E1 SN1 H HO* CMe2 H Eliminazione H Me C CMe2 H OH Sostituzione *OH E2/SN2 H OH SN2 H H Br Sostituzione HO* E2 Br Eliminazione Eliminazione vs.Sostituzione • Alogenuri terziari – Sostituzione via SN1 – Eliminazione via E1 o E2 • In presenza di nucleofili deboli e solventi polari la competizione è fra SN1 e E1 e si ha una miscela di prodotti. • In presenza di nucleofili forti e solventi apolari è favorita l’eliminazione con meccanismo E2. Eliminazione vs.Sostituzione • Alogenuri primari – Sostituzione via SN2 – Eliminazione via E2 – Non può avvenire né la SN1 né la E1 perché non si può formare il carbocatione • In presenza di nucleofili molto ingombrati e fortemente basici si può avere l’eliminazione con meccanismo E2. • In presenza di tutti gli altri nucleofili si ha prevalentemente la sostituzione via SN2. Eliminazione vs.Sostituzione • Alogenuri secondari – Sostituzione via SN1 o SN2 – Eliminazione via E1 o E2 • Si ha sempre una miscela di prodotti. • La sostituzione è favorita da nucleofili forti che non siano basi forti (SN2) • L’eliminazione è favorita dalle basi forti (E2). Reazioni biologiche • Negli ambienti biologici le reazioni di SN avvengono spesso su un substrato che è un difosfato organico piuttosto che un alogenuro alchilico. • Pertanto, il gruppo uscente è lo ione difosfato (PPi) • La dissociazione di un organodifosfato è una reazione biologica tipicamente favorita dalla complessazione di un catione divalente metallico, come Mg2+, che aiuta a neutralizzare la carica. O O R O P O P O O O 2+ Mg O dissociazione R + + O O P O P O O O 2+ Mg (PPi) Biosintesi Geraniolo isopentenil difosfato PPi PPi - PPi dimetilallil difosfato C H + C SN1 + PPi H eliminazione - H+ geranil difosfato C PPi + OH2 - PPi SN1 + O H H - H+ geraniolo OH Sintesi Adrenalina HO H Gruppo uscente HO H noradrenalina HO NH2 HO HO + SN2 HO NH2 O N CH3 S O H NH + 3 N CH3 H H adrenalina N + N O O N NH2 N S O H NH3 O N + OH OH SAM o S-adenosilmetionina (ione sulfonio) S-adenosilmonocisteina OH OH N N Reazioni biologiche di eliminazione + B H :B H H O CO2- HO CO2- HO CO2H OH H OH H 5-Diidrochinato O - CO2- H OH - H2O H H OH O OH H H OH 5-Diidrossichimato Biosintesi della tirosina HO H3N H + Tirosina Reazioni biologiche di eliminazione 3-Idrossibutirril tioestere HO H O H3C HO H H3C SR C N O SR - H2O H H H H N Tioestere crotonile O H + H+ H N N + H HO H H3C - H+ H3C O SR H Istidina (amminoacido nell’enzima) Biosintesi dei grassi SR H Alogenuri aromatici • Gli alogenuri vinilici ed arilici non danno reazioni di sostituzione nucleofila ma le reazioni tipiche dei composti aromatici. • Non danno reazioni SN2 perché quando il nucleofilo si avvicina al carbonio sp2 da retro viene respinto dalla nuvola elettronica π del doppio legame o dell'anello aromatico. • Non danno reazioni SN1 perché, il legame carbonio-alogeno è più corto e più forte poiché l'alogeno è legato ad un carbonio sp2 ed i carbocationi vinilici ed arilici che si dovrebbero formare sono altamente instabili. Cl Br Cl NO2 NO2 OH 2,4-dinitroclorobenzene p-bromofenolo clorobenzene
Scaricare