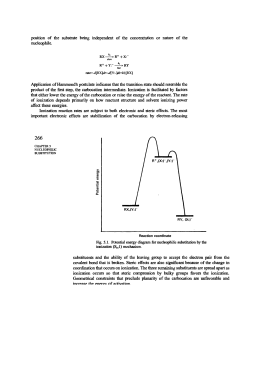
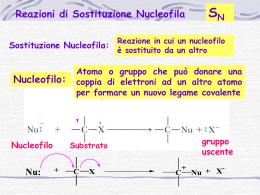
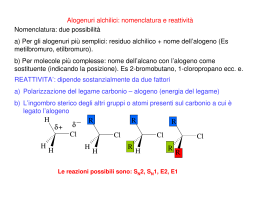
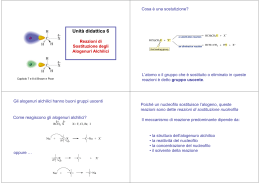
Illustrare le reazioni di eliminazione monomolecolare E1 Quando un alogenuro alchilico con almeno un atomo di idrogeno legato al carbonio adiacente a quello che porta l'alogeno reagisce con un nucleofilo, sono possibili due percorsi in competizioni: la sostituzione o l'eliminazione. Spesso le reazioni di sostituzione e di eliminazione avvengono contemporaneamente, a partire dagli stessi reagenti (il nucleofilo e il substrato). Può prelevare l'uno o l'altro tipo di reazione, a seconda della struttura del nucleofilo, della struttura del substrato e delle altre condizioni di reazione. Come nel caso delle reazioni di sostituzione, i meccanismi principali di eliminazione sono due: E2 ed E1; mentre la sostituzione può avvenire soltanto con meccanismo Sn1, l'eliminazione può avvenire sia con meccanismo E1 sia con meccanismo E2. In presenza di nucleofili deboli e di solventi polari la competizione è tra Sn1 ed E1. Il meccanismo E1 decorre in due stadi e ha il primo stadio in comune con il meccanismo Sn1. Il passaggio in comune è la ionizzazione del substrato, lenta e determinante la velocità, che porta alla formazione di un carbocatione. Sn1), oppure perdere un protone da un atomo di carbonio adiacente al carbonio positivo, nel mondo indicato dalla freccia curva, per formare un alchene (processo E1). Con gli alogenuri primari sono possibili soltanto i meccanismi Sn2 ed E2, perché non può avvenire la ionizzazione di un alogenuro primario a carbocatione primario, primo stadio richiesto da entrambi i meccanismo Sn1 ed E1. Con la grande maggioranza dei nucleofili, gli alogenuri primari danno prevalentemente prodotti di sostituzione (Sn2). Soltanto con nucleofili molto ingombranti e fortemente basici è favorito il processo E2. Per esempio, il t-butossido di Potassio è una base ingombrata: la sostituzione è ritardata e l'eliminazione è la reazione prevalente. Con gli alogenuri secondari invece, sono possibili tutti e quattro i meccanismi Sn2 ed E2, Sn1 ed E1. La distribuzione dei prodotti dipende molto dal nucleofilo (dalla sua forza come nucleofilo e come base) e dalle condizioni di reazione (solvente e temperatura). La sostituzione è favorita dai nucleofili forti che non siano basi forti (Sn2), oppure dai nucleofili più deboli, in solventi polari (Sn1); l'eliminazione è favorita dalle basi forti (E2). Negli alogenuri alchilici terziari l'eliminazione E2 avviene se si usa una base, mentre la sostituzione Sn1 e l'eliminazione E1 competono in condizioni neutre o acide. Dunque, una reazione di eliminazione avviene quando un protone e un gruppo uscente sono allontanati da atomi di carbonio adiacenti dando origine a un legame p tra i due atomi di carbonio. Quando il cloruro di tert- butile è trattato con una base, oltre ai prodotti di sostituzione Sn1 si formano anche altri prodotti. Uno dei quali è proprio il 2-metilpropene che proviene da una reazione di eliminazione. Poiché l'eliminazione E1 avviene in due stadi, non si può parlare di approccio sin o anti della base rispetto al gruppo uscente. Infatti, quando la base interviene, l'alogeno è già uscito. A differenza delle E2, le eliminazioni E1 che coinvolgono composti ciclici possono sempre avvenire, sia quando i gruppi da eliminare (H e X) hanno orientamento trans che quando hanno orientamento cis e non si trovano nello stesso piano
Scaricare