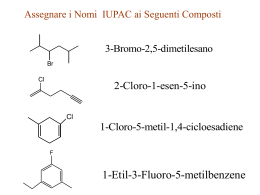
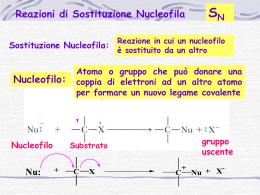
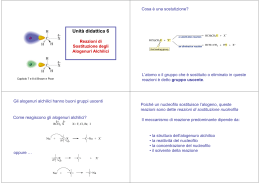
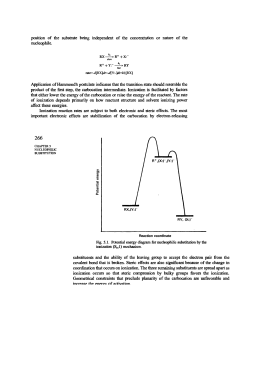
Reazioni di sostituzione dimolecolare SN2 per reazione di sostituzione nucleofila si intende una reazione in cui un nucleofilo ( specie chimica che prende parte a una reazione donando un doppietto elettronico e un elettrofilo per formare un legame) si sostituisce a un secondo nucleofilo che viene chiamato gruppo uscente. Questo tipo di reazione sono le più comuni e versatili in tutta la chimica organica. Tali reazioni possono avvenire in due meccanismi diversi chiamati SN1 e SN2 (“SN” sta per sostituzione nucleofila). La trasformazione che avviene in una sostituzione nucleofila, a prescindere dal meccanismo, è sostanzialmente la stessa: un nucleofilo Nu: reagisce con un substrato R-X e, sostituendo X ossia il gruppo uscente, dà vita al prodotto finale R-Nu: nel caso in cui Nu: sia neutro il prodotto finale sarà carico positivamente, nel caso in cui Nu: sia carico negativamente il prodotto finale sarà neutro. Nu: + R-X → R-Nu: (+) + X (-) Nu: (-) +R-X → R-Nu: + X (-) IL MECCANISMO DI REAZIONE SN2 i meccanismi SN1 e SN2 differiscono tra loro per i tempi di formazione del legame nuovo e rottura del legame vecchio. La reazione SN2 è una reazione concreta, ossia a un solo stadio, senza intermedi che avviene quando il nucleofilo attacca il substrato a 180⁰ rispetto al gruppo uscente. Quando il nucleofilo entra da una parte della molecola è la stessa coppia di elettroni a spingere fuori il gruppo uscente X: (-) dalla parte opposta portando via con sé la coppia di elettroni del legame C-X. La cinetica di reazione è di secondo ordine ossia la velocità di reazione può essere accelerata aumentando la concentrazione di uno dei due reagenti o di entrambi. Legge cinetica: v = k × (R-X) × (Nu:) Un esempio di questo tipo di reazione è: Br⁻+ CH3I → CH3Br + I⁻ Il diagramma energetico è: Durante questo meccanismo di reazione il carbonio sostituito cambia la sua ibridazione da sp3 a sp2 e subisce una inversione di configurazione Se ad esempio facciamo reagire (S)-2-bromobutano con idrossido si ottiene (R)-2-butanolo; l’inversione di configurazione si realizza passando in uno stadio di transizione piano. L’accessibilità spaziale è un fattore determinante nella reazione SN2 perché determina l’avvicinarsi fruttuoso o meno del nucleofilo al substrato. I substrati più voluminosi con l’atomo di carbonio portante l’alogeno ben protetto reagiscono molto più lentamente dei substrati in cui il carbonio è più scoperto. Gli alogenuri metilici (CH3-X) sono i più reattivi, seguiti dagli alchilici primari (RCH2X), come gli alogenuri di etile e propile. L’ ordine di reattività può essere riassunto in questo modo: metilico › primario › secondario › terziario Un'altra variabile che può influenzare una reazione SN2 è l’identità del gruppo uscente. Nella maggior parte dei casi il gruppo uscente che viene espulso si porta via una carica negativa e per questo i migliori gruppi uscenti sono quelli che danno origine a un anione più stabile (quelli degli acidi forti). Gli ioni alogenuro I⁻, Br⁻ o Cl⁻ sono i gruppi uscenti più comuni ma non sono i soli; al contrario anioni quali F⁻, OH⁻, OR⁻, NH⁻ si comportano raramente da gruppi uscenti. Anche la natura del nucleofilo influenza una reazione di sostituzione nucleofila SN2. La SN2 richiede nucleofili forti e per favorire l’attacco elettrofilo si predilige l’uso di solventi polari aprotici ( cioè solventi che non liberano ioni H⁺). Un gruppo uscente troppo buono invece tende infatti a uscire ancora prima dell’ attacco del nucleofilo favorendo una reazione SN1 Riassumendo, una reazione SN2 è favorità da: -gruppi uscenti deboli -forti nucleofili -alogenuri alchilici primari o secondari ●Reazione SN1→ solvente polare protico → nucleofilo debole→ gruppo uscente buono→ substrato terziario→ stereochimica: racemizzazione→ trasposizione: si ●Reazione SN2→ solventi polari aprotici→ nucleofilo forte→ gruppo uscente buono→ substrato metilico o primario→ stereochimica: inversione di configurazione→ trasposizione: no
Scaricare