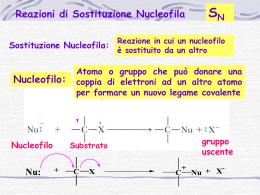
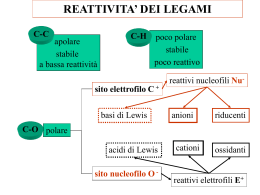
Effetto del solvente Vuole sapere il valore approssimato delle costante dielettriche. I solventi protici sono caratterizzati dall’avere un protone acido. La costante dielettrica non e’ legata alla polarita’, per questo motivo vedento che non c’era correlazione diretta sn state introdotte altre scale come la scala di reichardt (Et(30)), che e’ una scala di polarita’ empirica. La solvatazione abbassa l’energia della specie, aumentando la solvatazione dello stato di transizione si abbassa l’energia di attivazione (parte a sinistra). Se si solvata meglo il sostrato, si aumenta l’energia di attivazione (parte a destra). La Sn1 e’ aiutata da solventi polari se si parte da un substrato neutro, e’ sfavorita se si parte da un substrato carico positivamente. Stereochimica della Sn1 Sn1 porta a un carbocatione planare che puo’ essere attaccato da entrambe le facce, se il carbocatione pero’ e’ veramente planare e il nucelofilo interecetta il carbocatione planare isolato. Se si parte da RX ed esce Xche si allonatana allora il carbocatione e davvero planare. Se X- nn si allontana (non ha una vita sufficientemente lunga) allora il carbocatione non sara’ davvero planare, e si otterra’ comunque un prodotto non racemo (ritezione o inversione di chiralita’) SN2 caso limite Avviene in un unico passaggio che quindi influenza la velocita’ della reazione. Il gruppo entrante attacca il carbonio nella parte libera, e si forma un intermedio planare con i 3 sostituenti su un piano, resta un orbitale 2p legato al gruppo uscente e al gruppo entrante, con geometria bipiramide trigonale. Orbitali molecolari che interagiscono nella sn2 A destra la configurazione dello stato di transizione. Il carbonio e’ sdraiato con l’orbitale P orizzontale orizzontale. favorito Lo stato di transione a destra de e’ sfavorita e porta a ritenzione di configurazione. L’ordine favorito porta a inversione di configurazione, per quello che Sn2 porta a inversione di configurazione. Cinetica del secondo ordine,m primo ordine del reagente e del nucleofilo. Nella Sn2 il ruolo del nucleofilo e’ molto importante, cosa che nella Sn1 conta davvero poco. Il nuclofilo entra infatti nella formula della velocita’ di reazione [Y:-] Reazioni borderline (cioe’ tra Sn1 ed Sn2) e il concetto di coppia ionica I casi borderline sono moltissimi. Il concetto di coppia ionica (ion pair) e’ di grande importanza. E’ impossibile studiare una reazione organica senza quel concetto. La reattivita’ differesce a seconda del tipo di coppia ionica, tanto che e’ possibile spiegare tutta la reattivita’ con questo concetto. L’attacco nucleofilo puo’ avvenire in uno qualsiasi degli stati descritti, questo cambia il tipo di reazione. Se Y attacca gli Il concetto di coppia ionica afferma che quando si effettua una dissociazione (sia che Yattacchi, sn2 o no, sn1) come nella reazione scritta a fianco, quello che succede e’ che partendo da RX e c’e’ rottura eterolitica, si stacca il legame e gli ioni restano vicini (interazione elettrostatica) e la specie R+X- e’ detta coppia ionica intima. Lentamente il solvente si infila tra R+ ed X- (coppia ionica separata dal solvente), entra sempre piu’ solvente e infine gli ioni ri ritrovano dissociati. ioni completamente dissociati ati abbiamo racemizzazione. Se Y trova la coppia ionica intima prevale una inversione di configurazione. Quindi scegliendo accuratamente il solvente (quindi cambiando come la coppia ionica si separa) ottengo oltre a una modifica di velocita’ anche una stereochimica stereochimica differente, evitando la racemizzazione del prodotto. Carbocationi: La ionizzazione e’ una reazione endotermica sfavorita. In soluzione si possono osservare reazione di ionizzazione inosservabili senza solventi. Il tritile, carbocatione stabile (carbocatione di anelli benzenici) ha conformazione a elica perche’ gli anelli benzenici non riescono a stare planari (cit. “flippano”). Si fa la reazione e si osserva la pKR+, ottenendo la tabella. Gruppi elettron-attrattori attrattori hanno pKR molto bassa, rendendo il carbocatione molto stabile. Un’altra scala utilizzabile per determinare i carbocationi piu’ stabili e’ ottenuta dalla reazione Carbocationi benzilici Un sostituente elettrondonatore stabilizza la carica positiva per effetto mesomero rendendo il sistema piu’ stabile rispetto al semplice carbocatione benzilico. Sono S elettrondonatori gruppi come –OCH3, -NH NH2, F (elettrondonatore per effetto induttivo).. Mettendo gruppi elettronattrattori (effetto effetto –M) come C=N, si trova una formula di risonanza con 2 cariche positive adiacenti, struttura molto instabile per repulsione. Metodo di calcolo ab-initio initio Due carbocationi importanti sono il tropilio e il ciclopropenile, secondo la regola di huckel. La nucleofilia e’ un effetto di una base di lewis sulla velocita’ di una reazione, mentrte la basicita’ e’ un equilibrio termodinamico acido/base. La basicita’ e’ semplice da determinare, basta studiare la Kb, il termine nucleofilo (cinetico) e’ difficile da determinare perche’ non esiste un parametro La nuceofilia e’ stata indagata ata a lungo e sono state realizzate delle scale di nucleofilia. diretto. Molte proprieta’ influenzano il nucleofilo, come l’energia di solvatazione, la forza di legame tra C e Nu, la grandezza del nucleofilo, l’elettronegativita’ del nucleofilo, la polarizzabilita’ del nucleofilo. 1) l’alta energia di solvatazione alta energia di attivazione quindi bassa reattivita’ 2) un legame forte tra nucleofilo e carbonio porta a una energia di attivazione piu’ bassa. 3) piu’ il Nu e’ stericamente impedito meno e’ reattivo 4) Piu’ il nucleofilo e’ elettronegativo piu’ trattiene i suoi elettroni, piu’ un Nu e’ elettronegativo meno reagisce 5)La polarizzabilita’ indica la tendenza a deformare la nuvola elettronica, piu’ un Nu e’ polarizzabile piu’ e’ favorita la Sn2 La nucleofilicita’ segue un andamento diverso dalla basicita’ Concetti chiave della tabella: - a parita’ di nucleofilo, il sistema anionico e’ piu’ nucleofilo del sistema neutro. - scendendo sulla tavola periodica la nucleofilicita’ aumenta (F-<Cl-<Br-<I-) perche’ diminuisce la elettronegativita’, aumenta la polarizzabilita’ e diminuisce la solvatazione. - la nucleofilicita’ diminuisce lungo la riga La competizione Sn1/E1 e’ una competizione classica in quanto il nucleofilo puo’ agire da base o da nucleofilo. Nucleofilicita’ vs basicita’, approccio hard soft Reazioni di anioni con alogenuri alchilici Nu: vs B:, se l’attaccato e’ C sp3 che e’ un soft elettrofilo e’ favorita’ la nucleofilia e avviene la sostituzione, sost se l’attaccato e’ H+, eletrofilo hard e’ favorita la basicita’ e quindi l’eliminazione. Il gruppo uscente (Lg) influenza la velocita’ sia nella sn1 che nella sn2, poice’ il lg va via con la sua coppia di elettroni e’ lecito attendersi che la bonta’ del gruppo uscente uscente sia legato alla sua elettronegativita’ Scala dei gruppi uscenti dal piu’ veloce al piu’ lento. L’elettronegativita’ e’ un buon criterio, come e’ dimostrato dai primi 4 in classifica. classifi Nel caso degli alogeni pero’ la scala e’ opposta alla Elettronegativita, in quanto il criterio da considerare e’ la forza del legame C-X: X: minore forza miglior gruppo uscente. I migliori gruppi sn gli esteri solfonici Effetto della coniugazione presi un allile e un benzile, nelle sn1 sn veloci per stabilizzazione dell’intermedio, mantre nella sn2 sn stabili nello stato di transizione. Stereochimica: - sn2 atteso 100% di inversione della configurazione - sn1 dipende se la reazione va su ioni liberi o suna ina coppia ionica - meccanismi borderline: dipende dal tempo di vita degli intermedi, cioe’, se il tempo di vita degli inermedi siamo vicini a una Sn1, viceversa se il tempo di vita e’ corto. Il piu’ reattivo e’ quello a sinistra invece di quello a destra per effetto del gruppo vicinale. Inoltre si osserva che cambia la stereochimica nei due casi. La reazione con quello di destra c’e’ inversione di configurazione, mentre con quello a sinistra c’e’ ritenzione di configurazione. Il gruppo vicinale partecipa alla reazione quando ha stereochimica opportuna. il gruppo vicinale reagisce al posto del nucleofilo, quando ha caratteristiche nucleofilo e ha stereochimica esatta. Avviene una reazione intramolecolare, secondo lo schema in basso, un sistema cationico stabilizzato per risonanza. Avviene con inversione di configurazione, prima dell’attacco del nucleofilo esterno. solo dopo questa reazione intermolecolare avviene l’attacco del Nu: esterno. L’attacco intramolecolare lecolare non puo’ avvenire su trovano dalla stessa parte i due gruppi. perche’ si La diversa velocita’ e’ data dalla formazione di cicli piu’ o meno stabili. La massima velocita’ si ha quando il gruppo vicinale porta alla formazione di un ciclo a 5 o 6 atomi. Intermedio carbocationico: riarrangiamento - Shift 1,2 piu’ comune Gruppo migrante:H, aclchile, vinile, arile - Driving force termodinamica: formazione di un carbocatione piu’ stabile Emergie di attivazione pnon alte
Scaricare