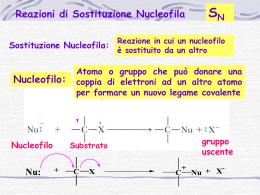
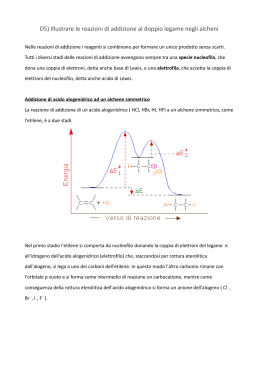
REATTIVITA’ DEI LEGAMI C-C apolare stabile a bassa reattività C-H poco polare stabile poco reattivo reattivi nucleofili Nu- sito elettrofilo C + basi di Lewis anioni riducenti C-O polare acidi di Lewis sito nucleofilo O - cationi ossidanti reattivi elettrofili E+ Reagenti organici H Radicali liberi specie chimiche con 1 elettrone spaiato H C H . Reagenti nucleofili –basi di Lewiscon doppietto non condiviso H C C H metile Reagenti elettrofili –acidi di Lewiscon lacuna elettronica o carica+ H H+ . vinile + SO3 + AlCl3 .. NH 3 .. HO 2 .. ( .. OH) - Reazioni organiche Reazioni organiche rottura e formazione nuovi legami legami covalenti Scissione omolitica Ognuno dei 2 atomi mantiene l’elettrone prima condiviso Cl—Cl Cl • + Cl • Scissione eterolitica L’atomo più elettronegativo trattiene la coppia di elettroni 2 siti molecolari con polarità opposta H—C=C —C — H—C — C —C — - + Delocalizzazione elettronica del C EFFETTO INDUTTIVO EFFETTO MESOMERO interessa legami il legame non è stabile permanente C+ C- Alogeni O reazione -NH2 con un Nu C—O C=C CH3 M+ ibridi di risonanza dipendono da elementi con doppietti elettronici disponibili cedono elettroni al C attirano doppietti M- reazione con E+ reazione con Nu- EFFETTO INDUTTIVO Atomi con elettronegatività diversa da C polarizzano anche i legami contigui - elettronegativo (elettronrepulsivo) +I CCH3 reazione con un Nu(-O-, -S-) il legame permanente + elettronegativo (elettronattrattivo) -I C+ Alogeni O -NH2 C-O C=C EFFETTO MESOMERO Forma intermedia tra 2 o più strutture (forme limite) equivalenti MESOMERO Prodotto della delocalizzazione di coppie di elettroni Nu- R C C C H H O H O R + C C C H H O H O REAZIONI E MECCANISMI sostituzione elemento C H ibridazione addizione geometria della molecola H H H H C C H H H C H H H H C H Reazione di Sostituzione Nucleofila Sn2 sostituzione di un gruppo (es. alogeno) con reagente nucleofilo reattivo nucleofilo: ione idrossido OHgruppo sostituendo: bromuro attacco del nucleofilo dalla parte opposta del gruppo da sostituire inversione stereochimica La velocità di reazione è influenzata sia dal substrato sia dal reagente nucleofilo formazione del composto intermedio V = kc[CH3Br][-OH] Meccanismo reazione SN2 Composto di partenza Composto intermedio sostituto sostituendo Composto finale Reazione di Sostituzione Nucleofila Sn1Prodotti simili a Sn2, ma diverso meccanismo la velocità di reazione dipende solo dalla concentrazione del substrato V = kc[substrato]. 1-Formazione del carbocatione, condiziona la velocità di reazione 2- attacco del reattivo nucleofilo al carbocatione 3- allontanamento di un protone da parte del bromo reazione possibile anche con reattivi scarsamente nucleofili come l’acqua o gli alcoli per formare alcoli ed eteri Sostituzione elettrofila E+ solfonazione nitrazione benzene e suoi derivati anello benzenico = base di Lewis reattivo E+ H2SO4 HNO3 H+ 1: reagente elettrofilo si lega al benzene carbocatione di risonanza stabile 2: aggiunta di un elettrone al protone aromaticità ristabilita Nota: la formazione del carbocatione –decisivo per la velocità di reazione- è fortemente endotermica, perché è non-aromatico Sostituzione radicalica Alogenazione con radicali liberi Inizio catena aggiunta di alogeno a un alcano in presenza di luce. Cl2 viene scisso da luce UV in due atomi Cl • Reazioni a catena 1- Cl • strappa un atomo H da un C terziario radicale terziario 2- radicale C• strappa a Cl2 un atomo Cl e resta un radicale Cl• il carbonio più sostituito dà il radicale più stabile Fine catena La reazione termina quando 2 radicali • si uniscono 2- ADDIZIONE a- ionica Nu: sul carbonio del carbonile C=O Nucleofila + NuNu H+ C=O + NuC+ C C O OO-H Un pH acido accentua la polarizzazione C+ e perciò la reazione viene favorita dalla catalisi acida Nu Addizione Nucleofila a Gruppi Carbonilici 1- il nucleofilo si lega al C parzialmente + del carbonile spingendo gli elettroni verso l’ O Esempi di reagenti Nucleofili: •reagenti di Grignard 2- il protone si lega e forma l’alcol •alcoli •ammine •Ioni acetile E + elettrofila 1- elettrofilo forte attrae gli elettroni del legame con formazione del carbocatione E+ = Elettrofilo Nuc: = Nucleofilo 2- il reattivo nucleofilo si lega velocemente al carbocatione configurazione trans Orientazione regola di Markovnikov nucleofilo legato al C più sostituito Esempi di addizione elettrofila: •idrossilazione •Idrogenazione •alogenazione Regola di Markovnikov addizione di un acido alogenidrico (es HBr) regola di Markovnikov H al C più ricco di H L’effetto I+ dei gruppi CH3 sul C legato all’alogeno rende più stabile il composto alogeno; al C più sostituito CH3 CH3 CH3-C=CH2 + HBr CH3-C-CH3 Br REATTIVI DI GRIGNARD (1901) alogenuri alchilici arilici reagiscono con Mg composti organo-metallici fortemente polari R-MgX - reagiscono facilmente con altri composti polari tutti i composti organici numerosi composti inorganici -CO2 e H2O – Reazioni con reattivi Grignard Il C del radicale legato a Mg è - e quindi nucleofilo Nu- - + R Mg X - + R Mg X O + + H H + Mg X H + R' C alcol H C H OH R + R H O Mg X R' H H X + R' C O aldeide O Mg O R + (H+) H O H Sostituzione elettrofila aromatica I 6 elettroni delocalizzati Reagente elettrofilo ACIDO DI LEWIS BASE DI LEWIS Catalizzatori scindono eteroliticamente i legami in modo da produrre cationi elettrofili che attaccano l’anello Carbocatione intermedio X:Y + catalizzatore + X + catalizzatore-Y: Catalizzatore-Y– + H+ Catalizzatore + HY NITRAZIONE catalizzatore Acido solforico H2SO4 HO-NO2 + H+ + HSO4H2O + NO2+ + HSO4HSO4- + H+ (del benzene) nitrobenzene SOLFONAZIONE + SO3reagente elettrofilo O O + S O Acido benzensolfonico
Scaricare