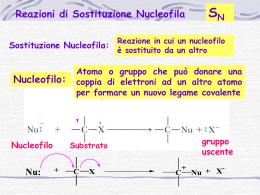
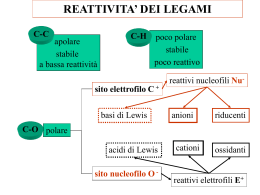
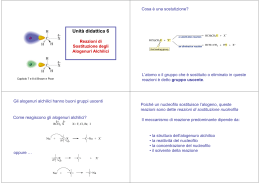
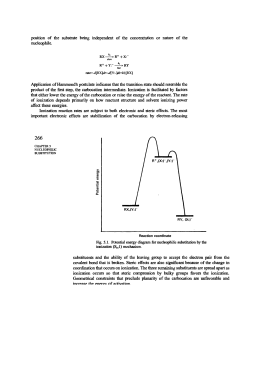
Reazione di sostituzione nucleofila bimolecolare SN2 Reazione di sostituzione nucleofila Gli alogenuri alchilici (composti organici con un atomo di alogeno legato a un carbonio saturo ibridato sp 3) sono elettrofili e quindi, quando reagiscono con nucleofili o basi, possono dar luogo a due tipi di reazione: la sostituzione del gruppo X (alogeno) da parte del nucleofilo o l’eliminazione di HX per formare un alchene. Il nucleofilo è una specie chimica che instaura un legame con l’elettrofilo, donando un doppietto elettronico ad esso durante una reazione. I nucleofili possono essere molecole neutre con doppietti elettronici non condivisi oppure molecole con ioni negativi. La reazione di sostituzione nucleofila degli alogenuri alchilici fu scoperta nel 1896 dal chimico tedesco Paul Walden, il qualche capì che gli acidi (+)- e (-)- malici potevano essere convertiti l’uno nell’altro. Trattando l’acido (-)-malico con PCl5 Walden isolò l’acido (+)-clorosuccinico. Quest’ultimo per reazione Ag2O umido, diede l’acido (+)-malico. Ugualmente, dalla reazione dell’acido (+)-malico con PCl5, Walden ottenne l’acido (-)-closuccinico, che per reazione con Ag2O umido, si trasformò in acido (-)-malico. Le trasformazioni del ciclo di Walden sono definite reazioni di sostituzione nucleofila, perché in ciascuno stadio avviene la sostituzione di un nucleofilo (ione cloruro Cl- o ione idrossido OH-) da parte di un altro nucleofilo. La reazione di sostituzione nucleofila generale è: R – X + Nu : R – Nu + X : -. Le sostituzioni nucleofile possono avvenire con due meccanismi: reazione SN1 e reazione SN2. La trasformazione complessiva che si ottiene nelle sostituzioni nucleofile, indipendentemente dal meccanismo, è la stessa: un nucleofilo (Nu : o Nu : -), reagendo con un substrato R - X, sostituisce il gruppo uscente X : - in modo da raggiungere il prodotto finale R – Nu. Se il nucleofilo è neutro (Nu:), il prodotto sarà carico positivamente, per necessità di conservazione della carica; mentre se il nucleofilo è carico negativamente (Nu:-) il prodotto sarà neutro. Nucleofilo carico elettricamente Prodotto neutro Nu : + R – X R – Nu + X : Nucleofilo neutro Prodotto carico positivamente Nu : + R – X R – Nu + + X : Reazione di sostituzione nucleofila SN2 La reazione SN2 è un processo in un solo stadio, senza fasi intermedie, che si realizza quando il nucleofilo attacca i substrato entrando a 180° rispetto al gruppo uscente. Quando il nucleofilo entra da una parte della molecola, è la coppia di elettroni presente sul nucleofilo, Nu : - , che spinge fuori il gruppo uscente, X : -, dalla parte opposta. Il gruppo uscente porta via con sé la coppia di elettroni del legame C – X. Nello stato di transizione della reazione si ha la parziale formazione del nuovo legame NU – C e, contemporaneamente, la parziale rottura del vecchio legame C – X; la carica negativa è condivisa dal nucleofilo che sta entrando e dal gruppo uscente che si sta allontanando. Esempio: reazione di OH- con l’ (S)-2-bromobutano. Velocità della reazione: la cinetica delle reazioni SN2 Nelle reazioni chimiche c’è una relazione diretta tra la velocità della reazione e la concentrazione dei reagenti. La reazione SN2 avviene in un solo stadio, quando substrato e nucleofilo entrano in collisione e reagiscono. A una data concentrazione dei reagenti la reazione decorre con una certa velocità. Raddoppiando la concentrazione del nucleofilo, la frequenza delle collisioni tra i due reagenti raddoppia e anche la velocità di reazione raddoppia. Per lo stesso motivo, raddoppiando la concentrazione del substrato, la velocità di reazione raddoppia. Esempio: reazione SN2 di CH3Br con OH – per dare CH3OH Raddoppiando la concentrazione di OH –, aumentano le collisioni tra i due reagenti e raddoppia la velocità di reazione. Allo stesso modo, raddoppiando la concentrazione di CH3Br (bromometano), raddoppia la velocità di reazione. Questo ci spiega il significato del “2” di SN2; infatti queste reazioni si definiscono bimolecolari perché due specie, l’alogenuro alchilico e il nucleofilo, partecipano allo stadio di cui si misura la velocità. La stereochimica e gli effetti sterici delle reazioni SN2 Nella reazione SN2 quando il nucleofilo attacca il substrato e comincia a spingere fuori il gruppo uscente dalla parte opposta, la configurazione della molecola si inverte. Il nucleofilo può avvicinare un substrato, per condurre a termine una reazione SN2, grazie all’ accessibilità sterica al carbonio che porta l’alogeno. I substrati voluminosi, con l’atomo di carbonio portante l’alogeno ben protetto dall’attacco, reagiscono molto più lentamente dei substrati nei quali tale atomo di carbonio è più accessibile. Gli alogenuri metilici (CH3 – X) sono i più reattivi, seguiti dagli alchilici primari ( RCH2 – X), come gli alogenuri di etile e propile. La ramificazione alchilica sul carbonio che porta il gruppo uscente, negli alogenuri secondari (R2CH – X), rallenta fortemente la reazione. L’ulteriore ramificazione arresta del tutto la reazione negli alogenuri terziari (R3C – X). Il gruppo uscente nelle reazioni SN2 La natura del gruppo uscente che viene scacciato dal nucleofilo è un’altra variabile che può influenzare la reazione SN2. I migliori gruppi uscenti sono quelli che conducono alla formazione degli anioni più stabili (gli anioni degli acidi forti), in quanto nella maggior parte dei casi il gruppo uscente che viene espulso porta con sé una carica negativa. Gli ioni alogenuro (I - , Br – o Cl -) sono i gruppi uscenti più comuni. Al contrario anioni quali F -, OH -, OR – e NH2 – si comportano raramente da gruppi uscenti.
Scaricare