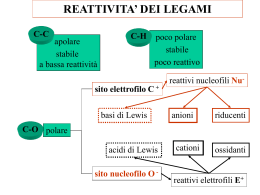
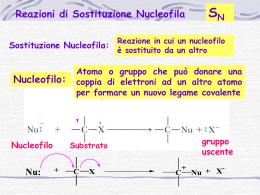
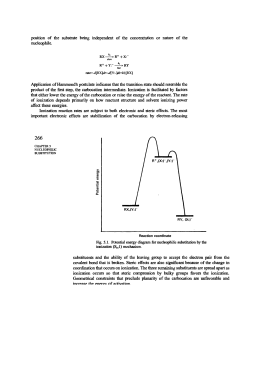
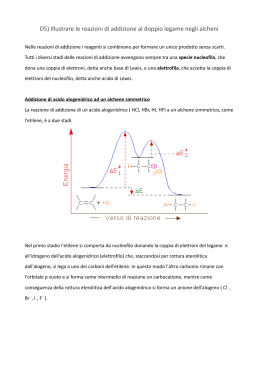
Sostituzione nucleofila SN1 Questo meccanismo di sostituzione viene attribuito al chimico tedesco Paul Walden (Wenden, 1863 – Gammertingen, 1957) che nel 1896 scoprì che gli acidi (+) e (-) malici potevano essere convertiti l’uno nell’altro tramite una serie di reazioni di sostituzioni semplici. Negli anni tra il 1920 e il 1930 vennero intrapresi studi per chiarire il meccanismo delle reazioni di sostituzioni nucleofila e per capire in che modo venissero realizzate le inversioni di configurazione. Prima di introdurre il concetto di sostituzione nucleofila dobbiamo conoscere cosa vuol dire essere “nucleofilo”. Un Nucleofilo altro non è che un atomo o un gruppo che può donare una coppia di elettroni ad un altro atomo per formare un nuovo legame covalente. Il meccanismo della sostituzione nucleofila è frequente negli alogenuri alchilici, ovvero negli alcani in cui è presente almeno un alogeno come ad esempio il 2bromo-butano. All'alogeno, che si distacca dalla molecola va a sostituirsi un nucleofilo, che presenta parziale o totale carica negativa come uno ione ossidrile OH- oppure possiamo definirlo come un composto che presenta almeno un doppietto elettronico libero da legami. Esistono due tipi di sostituzione: monomolecolare (sn1) o bimolecolare (sn2), a seconda che nel corso di essa si formi o meno un carbocatione (quando al distacco dell'alogeno l'alcano rimane per un determinato tempo in forma ionica). Si può riconoscere il tipo di reazione in questo modo: se al distacco dell'alogeno si forma un carbocatione terziario la reazione è sn1, se è primario ,invece, è sn2. Da notare che una reazione sn2 provoca un inversione di configurazione del composto, una reazione sn1 provoca la formazione di un racemo. Ma la scoperta più sorprendente è che la trasformazione complessiva, indipendentemente dal meccanismo, è la stessa: un nucleofilo(Nu) reagendo con un substrato R-X, sostituisce X per dare R-N. Se il nucleofilo è neutro il prodotto sarà carico negativamente; mentre il prodotto sarà neutro se il nucleofilo è carco negativante. Nu neutro Nu negativo :Nu + R-X =>R-Nu(+) + :X(-) :Nu(-) + R-X=>R-Nu + :X(-) Entriamo nello specifico della sostituzione nucleofila SN1 La velocità di reazione dipende solo dalla concentrazione del substrato essa avviene in 2 stadi: -Stadio lento: Viene espulso il gruppo uscente dal substrato, il gruppo uscente è molto poco basico (gli alogeni escono come alogenuri) si forma un carbocatione ( intermedio di reazione) e il substrato è 2°, 3°, allilico o benzilico, altrimenti il carbocatione che otteniamo è troppo instabile e la sua formazione è troppo lenta e ,inoltre, per stabilizzalo abbiamo bisogno di un solvente polare. -Stadio veloce: Entra il nuovo nucleofilo sul carbocatione. Il nucleofilo deve essere debole perché non deve aver fretta di reagire, poichési deve aspettare che si formi il carbocatione altamente elettrofilo poiché il carbocatione è planare, quindi il nucleofilo può attaccare da sopra o da sotto il piano e quindi si ottiene un racemo. Il meccanismo della reazione dipende da vari fattori come il tipo di substrato, il tipo di nucleofilo, il tipo di gruppo uscente ed il tipo di solvente usati. Gli alogeno metani (CH3-X) sono i substrati più reattivi, seguiti dagli alogenuri primari (RCH2-X). La reazione è molto più lenta per gli alogenuri secondari (R2CH-X) e ancor di più per i terziari (R3C-X).Questo a causa della diminuzione di accessibilità dell’atomo di carbonio che subisce l’attacco del nucleofilo all’aumentare del numero di gruppi alchilici legati ad esso.
Scaricare