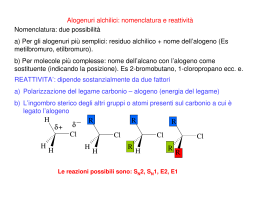
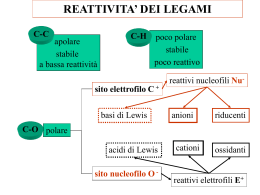
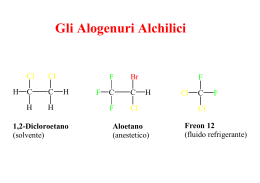
Chimica Organica 12 Sostituzioni nucleofile alchiliche Enrico Pontello Sostituzioni nucleofile I meccanismi di sostituzione nucleofila sono due: SN1 ed SN2. Sono meccanismi che avvengono a seconda della molecola che reagisce e dei solventi utilizzati. SN1 È un meccanismo MONOMOLECOLARE (1) che transita via carbocatione ed ha una cinetica del primo ordine: v = 𝑘 ∗ 𝑟𝑒𝑎𝑔𝑒𝑛𝑡𝑒 Per il passaggio via carbocatione il prodotto è racemico a causa dell’uguale probabilità di attacco da sopra o sotto. È tipico degli ALOGENURI TERZIARI. SN2 È un meccanismo BIMOLECOLARE (2) di tipo concertato ed ha una cinetica del secondo ordine: v = 𝑘 ∗ 𝑟𝑒𝑎𝑔𝑒𝑛𝑡𝑒 ∗ 𝑛𝑢𝑐𝑙𝑒𝑜𝑓𝑖𝑙𝑜 Per il meccanismo concertato il prodotto subisce un’ inversione della stereochimica negli alogenuri secondari. È tipico degli ALOGENURI PRIMARI. Alogenuri SECONDARI Gli alogenuri secondari possono reagire tramite entrambi i meccanismi, ma possiamo con particolari accorgimenti forzare l’uno o l’altro. SN1: reazione con nucleofili deboli in solventi polari protici come acqua e alcol SN2: reazione con basi o nucleofili deboli come I- e Ac- in solventi polari aprotici Nucleofili In ordine di bontà, i nucleofili (basi di Lewis) più comuni sono: al CARBONIO: CN- e reattivi di Grignard; all’AZOTO: NH3, ammine; all’OSSIGENO: alcoli, H2O; allo ZOLFO: tioli, SCN-. Anche gli ALOGENURI: migliori quelli a peso atomico maggiore. Gruppi uscenti La bontà del gruppo uscente determina se la reazione avviene oppure no. Un buon gruppo uscente è la base coniugata di un acido forte. Avviene solo la seconda reazione perché Br- è un miglior gruppo uscente essendo base coniugata di HBr che è più acido dell’acqua. Eliminazione Le reazioni di eliminazione portano all’elisione di parti della molecola la quale forma legami doppi. Secondo la regola di ZAITSEV si forma in gran prevalenza l’alchene più sostituito: viene sottratto con maggior probabilità l’idrogeno dal carbonio che già è legato al minor numero di idrogeni. E1 Il meccanismo di eliminazione E1 è monomolecolare via carbocatione con due passaggi. Si forma con grande prevalenza il secondo alchene nella forma entgegen: (E)-2-butene. E2 Il meccanismo di eliminazione E2 è bimolecolare ed avviene in un unico stadio. Mentre la base strappa l’idrogeno, l’alogenuro si allontana e il legame p si forma. ECB La reazione di b-eliminazione riguarda i composti carbonilici ed è causata dall’acidità degli idrogeni in a al carbonile. L’idrogeno acido in alfa viene strappato dalla base ed il bromo in beta viene eliminato. Il prodotto è stabilizzato dalla coniugazione dei due doppi legami. Eliminazione nei cicli Negli alogenuri alchilici ciclici l’eliminazione avviene con l’uscita dell’alogenuro e di un idrogeno che siano tra loro in configurazione trans. sostituzione VS eliminazione Utilizzando una base forte come NaOH il prodotto maggioritario sarà quello di eliminazione. Utilizzando un nucleofilo come H2O prevarrà la sostituzione. sostituzione VS eliminazione Un alogenuro terziario reagisce con un nucleofilo debole sia via SN1 che E1. sostituzione VS eliminazione Questo è un esempio di selettività per ingombro del nucleofilo/base che, nel secondo caso con il terbutilato di sodio, fatica a scontrarsi nel modo giusto con l’alogenuro primario per dare la sostituzione. sostituzione VS eliminazione Gli alogenuri secondari sono quelli con il maggior numero di meccanismi possibili. epilogo alogenuro meccanismo CH3X SN 2 L’unico meccanismo possibile per i alogeno-metani SN 2 La reazione prevalente con buoni nucleofili/basi deboli E2 La reazione prevalente con basi forti ingombrate primario RCH2X SN1 / E1 secondario R2CHX Non si verificano per l’instabilità dei carbocationi primari SN 2 La reazione prevalente con basi deboli E2 La reazione prevalente con basi forti SN1 / E1 E2 terziario R3CX condizioni SN1 / E1 SN 2 Comuni in reazioni con nucleofili deboli in solvente polare protico La reazione prevalente con basi forti Reazioni prevalenti con nucleofili/basi deboli Raramente osservate a causa dell’ingombro su C terziari
Scaricare