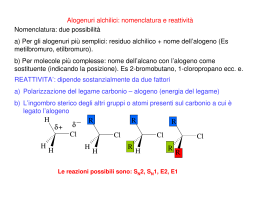
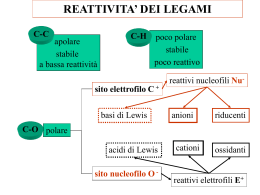
REAZIONE DI SOSTITUZIONE NUCLEOFILA MONOMOLECOLARE SN1 Gli alogenuri organici sono composti in cui un atomo di idrogeno è rimpiazzato con un atomo di alogeno. I due tipi di alogenuri organici più comuni sono gli alogenuri alchilici (di natura alifatica) e gli alogenuri arilici (di natura aromatica). Gli alogenuri alchilici sono in genere più reattivi degli alogenuri arilici. Gli alogenuri alchilici solitamente vanno incontro a due tipi di reazione che sono la sostituzione e l’eliminazione. Questi due tipi di reazione competono l’una con un’altra. Queste due reazioni avvengono in presenza di un reagente nucleofilo. In una reazione di sostituzione il nucleofilo (indicato nelle equazioni con ) attacca l’atomo di carbonio che è legato all’alogeno e lo rimpiazza (o sostituisce). L’atomo di alogeno è indicato come gruppo uscente. SOSTITUZIONE + + In una reazione di eliminazione, il nucleofilo attacca l’atomo di idrogeno sul carbonio adiacente a quello cui è legato l’atomo di alogeno. Si forma un doppio legame tra l’atomo di carbonio che porta l’alogeno e l’atomo di carbonio adiacente. Nell’eliminazione entrambi gli atomi, l’alogeno e l’idrogeno sul carbonio adiacente sono gruppi uscenti. ELIMINAZIONE SOSTITUZIONE NULEOFILA In una reazione di sostituzione di un alogenuro alchilico, ciò che si forma dipende dal tipo di nucleofilo usato nella reazione. Sono riportati di seguito alcuni comuni nucleofili. Ione idrossido Ione metossido Ione bisolfuro Ione ioduro Ione cianuro ammoniaca Gruppo amminico Gruppo ossidrilico Acqua La molecola di un alogenuro alchilico presenta una certa polarità, in quanto l’alogeno è l’elemento più fortemente elettronegativo e cioè quello che, più di ogni altro, ha la capacità di attrarre a sé gli elettroni di legame. Monoclorometano Cloruro di metile Sull’alogeno si crea perciò una parziale carica negativa ( ) e pertanto l’atomo di carbonio, al quale l’alogeno è attaccato, si carica in modo parzialmente positivo ( ). In questo caso, infatti, il carbonio si comporterà nelle reazioni come un centro di attacco da parte di agenti nucleofili, avidi di cariche positive. La principale reazione degli alogenuri alchilici sarà dunque di sostituzione nucleofila. Tale reazione può avvenire principalmente in due modi: per attacco retroattivo (SN2) e per scissione ionica (SN1). 1) Il primo meccanismo è definito di retroattacco perché si ritiene che il reagente nucleofilo si avvicini alla molecola dal lato opposto rispetto all’atomo di alogeno. È in genere il processo ipotizzabile per alogenuri alchilici primari, a cui l’agente nucleofilo si attacca provoncando un contemporaneo distacco dell’alogeno. SN2: SOSTITUZIONE CON ATTACCO DA RETRO Dove è l’agente nucleofilo con un doppietto a disposizione. Nelle varie tappe del processo si forma un complesso intermedio in cui OH e Br sono entranbi attratti dal carbonio, ma, una volta attaccatosi alla molecola il nuovo componente, ovviamente più nucleofilo dell’alogeno che era attaccato prima, il bromo si stacca come ione carico negativamente. 2) Se l’alogenuro alchilico è però di tipo terziario e cioè l’alogeno è legato ad un atomo di carbonio a cui sono attaccati altri tre gruppi metilici, tali gruppi impediscono all’agente nucleofilo di far sentire la sua influenza sull’atomo di carbonio parzialmenre carico positivamente, per un fenomeno noto come ingombro sterico (i gruppi metilici sono, cioè, molecole piuttosto grosse, che impediscono all’agente nucleofilo di avvicinarsi e sentire l’influenza del carbonio). È necessario staccare prima l’alogeno mediante un solvente adatto formando così un composto intermedio instabile ( fase lenta). Successivamenre l’agente nucleofilo ristabilirà la situazione attaccandosi alla molecola dell’intermedio (fase veloce). SN1: SOSTITUZIONE IN CUI AVVIENE I gruppi metilici favoriscono il distacco dello ione bromo in quanto sono elettron-donatori, e, in certo senso, «pompano» gli elettroni di legame verso l’atomo di carbonio prima e quindi facilitano il distacco dell’alogeno poi. Nello stadio lento della rezione quindi si ha la formazione del carbocatione. STEREOCHIMICA DELLA REAZIONE SN1 Quando si fa reagire in condizione SN1 un alogenuro alchilico otticamente attivo si genera come prodotto intermedio un carbocatione ibridizzato planare; questo può essere attaccato dal nucleofilo entrante su entrambi i lati con uguale probabilità. Il prodotto finale avrà una quasi completa racemizzazione. GRUPPI USCENTI NELLE REAZIONI SN1 La reattività degli alogenuri alchilici, sia nelle reazioni SN1, sia nelle reazioni SN2, è determinata in parte dalla natura del gruppo uscente. In generale vi è una buona correlazione tra la forza dell’acido H−X e la reattività di R−X, nel senso che maggiore è la forza dell’acido alogenidrico HX, più facilmente l’alogeno X- viene sostituito, e quindi più reattivo è l’alogenuro alchilico RX. Poiché la forza degli acidi alogenidrici segue l’ordine: HI>HBr>HCl>HF, l’ordine di reattività degli alogenuri alchilici, a parità del gruppo R, è perciò: R−I> R−Br> R−Cl> R−F VELOCITA’ DI REZIONE SN1 Poichè nella formazione dello stato di transizione viene generato un carbocatione, gli alogenuri alchilici che generano i carbocationi più stabili reagiranno più velocemente. I residui alchilici tendono a stabilizzare il carbocatione sia per effetto induttivo che iperconiugativo. In questo modo un carbocatione terziario è più stabile di un carbocatione secondario che a sua volta è più stabile di un carbocatione primario. L'ordine di reattività degli alogenuri alchilici è quindi: terziario > secondario > primario > metilico
Scaricare