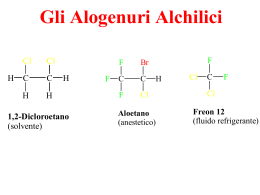
Gli Alogenuri Alchilici H Cl Cl C C H H H 1,2-Dicloroetano (solvente) F F Br C C F Cl F H Aloetano (anestetico) Cl C F Cl Freon 12 (fluido refrigerante) Regole IUPAC per la Nomenclatura degli Alogenuri Alchilici 1.Trovare e nominare la più lunga catena di atomi di carbonio.Se è presente un legame multiplo bisogna scegliere la catena più lunga che lo contiene. 2.Numerare la catena partendo dall'atomo di carbonio terminale più vicino ad un sostituente, sia esso un gruppo alchilico o un alogeno. 3.Identificare e nominare i gruppi e gli atomi di alogeno attaccati a questa catena. 4.Designare la posizione di ogni gruppo o atomo sostituente con l'appropriato numero e nome. 5.Assemblare il nome, elencando i gruppi in ordine alfabetico. I prefissi di, tri, tetra, etc., usati per designare più di un gruppo dello stesso tipo, non sono considerati ai fini dell'elencazione in ordine alfabetico. Polarizzazione del Legame C-X negli Alogenuri Alchilici Le Reazioni di Sostituzione Nucleofila degli Alogenuri Alchilici _ + R Nu + X R X + Nu R X + Nu _ R Nu + X _ Alcune Reazioni tipiche degli Alogenuri Alchilici Il Meccanismo Sn2 _ HO _ + δ_ _ Nu HO CH3 CH3 Br C X Nu Br + δ_ C X X C + X_ CH3S- + H3C CH CH2CH3 Br H3C CH CH2CH3 + BrSCH3 sn2loop(4).xyz Diagramma Energetico per una Reazione che Decorre con Meccanismo Sn2 Caratteristiche delle Reazioni Sn2 1) Cinetica di reazione globalmente del secondo ordine, primo ordine in alogenuro alchilico e primo ordine in nucleofilo: v=k x [Alog.][Nuc.] 2) Stereochimica delle reazioni con inversione di configurazione all'atomo di carbonio che subisce l'attacco nucleofilo: H H3C H _ Br* C *Br Br CH3 C + Br_ CH2CH3 H3CH2C (S)-2-Bromobutano (R)-2-Bromobutano 3) Effetti Sterici: Le Reazioni Sn2 sono molto sensibili all'ingombro sterico attorno all'atomo di carbonio che subisce l'attacco nucleofilo: CH3 H3C C H H Br << H3C CH3 C Br CH3 < H H C Br < H C Br H CH3 4) Effetto del gruppo uscente: i migliori gruppi uscenti sono quelli che portano alla formazione degli anioni più stabili: NH2- < CH3O < OH- < - CH3COO- < F << Cl- < Br- < I- Il Meccanismo Sn1 CH3 H3C C CH3 Lento Cl H3C CH3 CH3 Veloce + C + H2O H3C C CH3 CH3 CH3 H3C + CH3 CH3 H3C C + C CH3 Cl- H O + H H O + H CH3 Veloce H3C C CH3 O H + H+ Caratteristiche delle Reazioni Sn1 1) Cinetica di reazione globalmente del primo ordine, primo ordine in alogenuro alchilico: v=k x [Alog.] 2) Stereochimica delle reazioni con racemizzazione all'atomo di carbonio che subisce l'attacco nucleofilo: Ph CH3 Ph H3C C Ph C + Br HO CH2CH3 H3CH2C C + Ph C (S)-2-Fenil2-Bromobutano (R)-2-Fenil2-Bromobutano 3) Effetti Sterici: Le Reazioni Sn1 sono meno sensibili all'ingombro sterico delle Reazioni Sn2; La reattività è invece dominata dalla stabilità del carbocatione che si viene a formare ed è quindi opposta a quella osservata nelle Sn2: H H C H H Br << H H non reagisce via Sn1 C Br R < R C R Br R < R C Br R 4) Effetto del gruppo uscente: i migliori gruppi uscenti sono quelli che portano alla formazione delle specie più stabili similmente a quanto osservato nelle Sn2: CH3COO- < F- < < H2O = Cl- < Br- < I- OH H3CH2C CH2CH3 H2O (S)-2-Fenil2-Bromobutano H3C CH3 Diagramma Energetico per una Reazione che Decorre con Meccanismo Sn1 Il Meccanismo della Reazione di Eliminazione E2 H C OH- + C C C + H2O + Br- Br R H B R C R H C R C R R δ+ B Br C C R R R R X δ- R C R Stato di Transizione per la Eliminazione E2 Diagramma Energetico per una Reazione che Decorre con Meccanismo E2 La Reazione di Eliminazione E2 La Reazione di Eliminazione che Decorre con Meccanismo E1 Nucleofilo Nucleofili Anionici ( Basi deboli) (RS , SCN-, I-, Br-, N3-, CN- etc.) Nucleofili Anionici ( Basi Forti) ( HO-, RO-) Nucleofili Neutri (H2O, ROH, RSH, R3N) Gruppo Alchilico Primario RCH2- Sostituzione SN2 veloce. La velocità di reazione può essere ridotta dalla sostituzione in β come nel caso del neopentile. Sostituzione SN2 veloce. Può verificarsi anche una eliminazione E2. Sostituzione SN2 (N ≅ S >>O) Secondario R2CH- Sostituzione SN2 più eliminazione E2 (dipende dalla basicità del nucleofilo). La velocità di reazione può essere ridotta dalla sostituzione in β e questo aumenterà la eliminazione. La eliminazione E2 sarà predominante. Sostituzione SN2 (N ≅ S >>O) In solventi fortemente polari, come acqua, dimetilsolfossido e acetonitrile, si possono avere anche prodotti derivanti da SN1 e E1. Terziario R3C- La eliminazione E2 predomina con la maggior parte dei nucleofili (anche se sono basi deboli). In solventi fortemente polari, come acqua, dimetilsolfossido e acetonitrile, si possono avere anche prodotti derivanti da SN1 e E1. La eliminazione E2 predomina. In solventi fortemente polari, come acqua, dimetilsolfossido e acetonitrile, si possono avere anche prodotti derivanti da SN1 e E1. Eliminazione E2 con nucleofili azotati (sono basici). Nessuna sostituzione SN2 . In solventi fortemente polari, come acqua, dimetilsolfossido e acetonitrile, si possono avere anche prodotti derivanti da SN1 e E1. Allile H2C=CHCH2 - Veloce sostituzione SN2 nel caso di alogenuri 1° e 2°. Nel caso dei 3° si ha una lenta sostituzione SN2 oppure, se il nucleofilo è moderatamente basico, una eliminazione E2. In solventi fortemente polari, come acqua, dimetilsolfossido e acetonitrile, si possono avere anche prodotti derivanti da SN1 e E1. Veloce sostituzione SN2 nel caso di alogenuri 1°. Nel caso dei 2° si ha una competizione fra SN2 ed E2. Nel caso dei 3° la Eliminazione E2 domina. In solventi fortemente polari, come acqua, dimetilsolfossido e acetonitrile, si possono avere anche prodotti derivanti da SN1 e E1. Nucleofili all'azoto ed allo zolfo danno Sostituzione SN2 nel caso di alogenuri 1°e 2°. Gli alogenuri 3° daranno eliminazione E2 con nucleofili azotati (perchè sono basici). In solventi fortemente polari, come acqua, dimetilsolfossido e acetonitrile, si possono avere anche prodotti derivanti da SN1 e E1. L'idrolisi sarà favorita nel caso di alogenuri 2° & 3°. Benzile C6H5CH2- Veloce sostituzione SN2 nel caso di alogenuri 1° e 2°. Nel caso dei 3° si ha una lenta sostituzione SN2 oppure, se il nucleofilo è moderatamente basico, una eliminazione E2. In solventi fortemente polari, come acqua, dimetilsolfossido e acetonitrile, si possono avere anche prodotti derivanti da SN1 e E1. Veloce sostituzione SN2 nel caso di alogenuri 1°. Nel caso dei 2° si ha una competizione fra SN2 ed E2. Nel caso dei 3° la Eliminazione E2 domina. In solventi fortemente polari, come acqua, dimetilsolfossido e acetonitrile, si possono avere anche prodotti derivanti da SN1 e E1. Nucleofili all'azoto ed allo zolfo danno Sostituzione SN2 nel caso di alogenuri 1°e 2°. Gli alogenuri 3° daranno eliminazione E2 con nucleofili azotati (perchè sono basici). In solventi fortemente polari, come acqua, dimetilsolfossido e acetonitrile, si possono avere anche prodotti derivanti da SN1 e E1. L'idrolisi sarà favorita nel caso di alogenuri 2° & 3°.
Scaricare