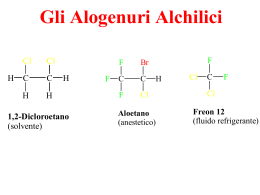
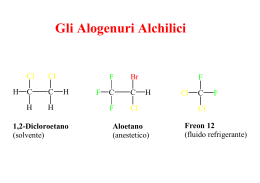
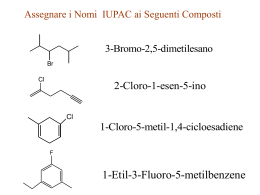
Competizione tra reazioni di sostituzione e di eliminazione δ+ C Centro elettrofilo δ+ H CH2 G δPotenziale buon Centro elettrofilo gruppo uscente Si distinguono due principali meccanismi di eliminazione: E1 (unimolecolare) E2 (bimolecolare) Reazione di Eliminazione Favorita dalle temperature elevate H C C + :Y – C C + H Y + :X X β-eliminazione – Regioselettività: In chimica la regioselettività è la caratteristica di una reazione chimica di procedere preferenzialmente con la rottura o formazione di determinati legami tra quelli possibili, con la produzione di un dato composto chimico che risulta favorita rispetto a quella di un altro correlato Regola di Zaitsev: se l’alogenuro alchilico possiede due carboni β, il prodotto preferenziale è quello che si ottiene per rimozione del protone dal carbonio β legato al minor numero di idrogeni. Quindi il prodotto principale è l’alchene più sostituito, termodinamicamente più stabile. Alchene C non sostituito Alchene H R C C H H H R H R R C C C H H H R R R R C R C C H R monosostituito C R trisostituito Alchene C H Alcheni disostituiti H H C Alchene tetrasostituito R Orientamento nelle reazioni E2 Br Prodotto secondario H2C H H alchene meno sostituito BBr H2C H H B- alchene più sostituito Prodotto principale Esempi Meccanismo di eliminazione E2 E2 CH3CH2 •• – O •• •• Meccanismo bimolecolare Br Basi usate nelle reazioni di Eliminazione -OH/etanolo CH3CH2O-/etanolo (CH3)3CO-/alcol terzbutilico Dal momento che anche questo meccanismo è bimolecolare e segue quindi una cinetica del 2° ordine esiste una analogia e quindi una forte Competizione tra Sn2 ed E2 Eliminazione contro Sostituzione La reazione principale di un alogenuro alchilico secondario e uno ione alcossido (base forte) è l’eliminazione attraverso il meccanismo E2. Esempio CH3CHCH3 Br NaOCH2CH3 etanolo, 55°C CH3CHCH3 + CH3CH=CH2 OCH2CH3 (13%) (87%) Quando è favorita la sostituzione? Siccome la reazione principale di un alogenuro alchilico con un alcossido è la E2, possiamo aspettarci che la percentuale di sostituzione cresca con: 1) diminuzione dell’ingombro al carbonio che porta il gruppo uscente Alogenuri alchilici poco ingombrati diminuzione dell’ingombro al carbonio che porta il gruppo uscente aumenta la sostituzione. Alogenuro alchilico primario CH3CH2CH2Br NaOCH2CH3 etanolo, 55°C CH3CH2CH2OCH2CH3 + (91%) CH3CH=CH2 (9%) Ma una base molto ingombrata può favorire l’eliminazione anche con un alogenuro alchilico primario. Alogenuro primario + base ingombrata CH3(CH2)15CH2CH2Br KOC(CH3)3 Alcol tert-butilico, 40°C CH3(CH2)15CH2CH2OC(CH3)3 + CH3(CH2)15CH=CH2 (13%) (87%) Base dell’ Alcol tert-butilico Nucleofilo Nucleofili Anionici ( Basi deboli) (RS-, SCN-, I-, Br-, N3-, CN- etc.) Nucleofili Anionici ( Basi Forti) ( HO-, RO-) Nucleofili Neutri (H2O, ROH, RSH, R3N) Nucleofili poco basici Nucleofili poco basici aumentano la sostituzione relativamente alla eliminazione Alogenuro secondario + nucleofilo poco basico CH3CH(CH2)5CH3 Cl KCN pKa (HCN) = 9.1 DMSO CH3CH(CH2)5CH3 (70%) CN Nucleofili poco basici Nucleofili poco basici aumentano la sostituzione relativamente alla eliminazione Alogenuro secondario + nucleofilo poco basico I NaN3 N3 (75%) pKa (HN3) = 4.6 Alogenuri alchilici terziari Gli alogenuri alchilici terziari sono talmente ingombrati che l’eliminazione predomina con nucleofili anionici. Solo in reazioni di solvolisi la sostituzione predomina sull’eliminazione. esempio (CH3)2CCH2CH3 Br EtOH CH3 CH3CCH2CH3 OCH2CH3 in etanolo, 25°C 64% (SN1) EtO- /EtOH CH3 CH3C=CHCH3 con etossido di sodio in etanolo, 25°C A 40°-50°da eliminazione (E1) 99% 36% (E2) CH3 CH3 Meccanismo E1 .. : Br .. C CH3 Stadio unimolecolare lento H3C + C CH3 CH3 + .. – : Br : .. 1° stadio In comune con Il 1° stadio della Sn1 CH3 CH3 Meccanismo E1 .. : Br .. C CH3 1° stadio unimolecolare lento H3C + C CH3 CH3 + .. – : Br : .. H H3C + C CH2 base Meccanismo E1 CH3 2° stadio stadio bimolecolare veloce CH3 C H3C CH2 Dal momento che il meccanismo E1 ha la stessa equazione cinetica del meccanismo Sn1 esiste una forte competizione tra questi 2 percorsi di reazione. Cinetica del primo ordine Si forma di preferenza l’alchene più sostituito Sostituzione o eliminazione? Competizione fra eliminazione e sostituzione Con un alogenuro alchilico primario: con nucleofili forti, si ha sostituzione SN2 con basi forti e stericamente impedite, si ha eliminazione E2 Con un alogenuro alchilico terziario: con nucleofili o basi deboli, si ha una miscela di prodotti SN1 ed E1 con basi forti, si eliminazione E2 Con un alogenuro alchilico secondario: con nucleofili e basi forti, si ha una miscela di prodotti SN2 ed E2 con basi forti e stericamente impedite, si ha eliminazione E2 In definitiva…. -Alogenuri alchilici primari danno sostituzione nucleofila, con il meccanismo SN2 tranne che in presenza di una base ingombrata -Alogenuri alchilici terziari danno prevalentemente la eliminazione (E1 +E2) tranne che in condizione di solvolisi (meccanismo SN1) -Alogenuri alchilici secondari danno eliminazione E2 soprattutto se trattati a temperature elevate con una base forte e poco nucleofila altrimenti danno sostituzione via SN2 in presenza di un buon nucleofilo H3C CH2 CH2 CH2 Cl + CH3O25° metanolo H3C CH2 CH2 CH2 OCH3 H3C CH2 CH2 CH2 Cl CH3 + H3C C O-K CH3 H3C CH2 C H CH2 alcol terzbutilico CH3 H3C C I CH3 + CH3OH CH3 H3C C OCH3 CH3 25° 50° H3C H H3C H I H I CH3 + CNDMSO + H2O H3C H 25° CH3 H3C C CH2 H CN H3C H OH CH3 H3C H CH3 OH Nucleofilo Nucleofili Anionici ( Basi deboli) (RS , SCN-, I-, Br-, N3-, CN- etc.) Nucleofili Anionici ( Basi Forti) ( HO-, RO-) Nucleofili Neutri (H2O, ROH, RSH, R3N) Gruppo Alchilico Primario RCH2- Sostituzione SN2 veloce. La velocità di reazione può essere ridotta dalla sostituzione in β come nel caso del neopentile. Sostituzione SN2 veloce. Può verificarsi anche una eliminazione E2. Sostituzione SN2 (N ≅ S >>O) Secondario R2CH- Sostituzione SN2 più eliminazione E2 (dipende dalla basicità del nucleofilo). La velocità di reazione può essere ridotta dalla sostituzione in β e questo aumenterà la eliminazione. La eliminazione E2 sarà predominante. Sostituzione SN2 (N ≅ S >>O) In solventi fortemente polari, come acqua, dimetilsolfossido e acetonitrile, si possono avere anche prodotti derivanti da SN1 e E1. Terziario R3C- La eliminazione E2 predomina con la maggior parte dei nucleofili (anche se sono basi deboli). In solventi fortemente polari, come acqua, dimetilsolfossido e acetonitrile, si possono avere anche prodotti derivanti da SN1 e E1. La eliminazione E2 predomina. In solventi fortemente polari, come acqua, dimetilsolfossido e acetonitrile, si possono avere anche prodotti derivanti da SN1 e E1. Eliminazione E2 con nucleofili azotati (sono basici). Nessuna sostituzione SN2 . In solventi fortemente polari, come acqua, dimetilsolfossido e acetonitrile, si possono avere anche prodotti derivanti da SN1 e E1. Allile H2C=CHCH2 - Veloce sostituzione SN2 nel caso di alogenuri 1° e 2°. Nel caso dei 3° si ha una lenta sostituzione SN2 oppure, se il nucleofilo è moderatamente basico, una eliminazione E2. In solventi fortemente polari, come acqua, dimetilsolfossido e acetonitrile, si possono avere anche prodotti derivanti da SN1 e E1. Veloce sostituzione SN2 nel caso di alogenuri 1°. Nel caso dei 2° si ha una competizione fra SN2 ed E2. Nel caso dei 3° la Eliminazione E2 domina. In solventi fortemente polari, come acqua, dimetilsolfossido e acetonitrile, si possono avere anche prodotti derivanti da SN1 e E1. Nucleofili all'azoto ed allo zolfo danno Sostituzione SN2 nel caso di alogenuri 1°e 2°. Gli alogenuri 3° daranno eliminazione E2 con nucleofili azotati (perchè sono basici). In solventi fortemente polari, come acqua, dimetilsolfossido e acetonitrile, si possono avere anche prodotti derivanti da SN1 e E1. L'idrolisi sarà favorita nel caso di alogenuri 2° & 3°. Benzile C6H5CH2- Veloce sostituzione SN2 nel caso di alogenuri 1° e 2°. Nel caso dei 3° si ha una lenta sostituzione SN2 oppure, se il nucleofilo è moderatamente basico, una eliminazione E2. In solventi fortemente polari, come acqua, dimetilsolfossido e acetonitrile, si possono avere anche prodotti derivanti da SN1 e E1. Veloce sostituzione SN2 nel caso di alogenuri 1°. Nel caso dei 2° si ha una competizione fra SN2 ed E2. Nel caso dei 3° la Eliminazione E2 domina. In solventi fortemente polari, come acqua, dimetilsolfossido e acetonitrile, si possono avere anche prodotti derivanti da SN1 e E1. Nucleofili all'azoto ed allo zolfo danno Sostituzione SN2 nel caso di alogenuri 1°e 2°. Gli alogenuri 3° daranno eliminazione E2 con nucleofili azotati (perchè sono basici). In solventi fortemente polari, come acqua, dimetilsolfossido e acetonitrile, si possono avere anche prodotti derivanti da SN1 e E1. L'idrolisi sarà favorita nel caso di alogenuri 2° & 3°.
Scaricare