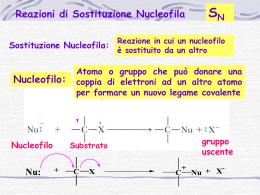
Laboratorio di chimica organica classe 3 ocb a.s.2010/11 DIFFERENZA TRA UNA REAZIONE SN1 ED UNA SN2 Questa esperienza possiamo suddividerla in due fasi, la prima consiste nel sintetizzare il cloruro di terzbutile partendo dall’alcol tezbutilico attraverso un meccanismo SN1. La seconda fase dell’esperienza consiste nel sintetizzare il bromuro di normalbutile partendo dal alcol normal butilico. Prima di passare all’esperienza pratica di laboratorio faremo un piccola introduzione teorica riguardante i meccanismi di reazione. Reazione di tipo SN1: il meccanismo SN1 è un processo in due passaggi, nel primo, quello lento, il legame tra carbonio ed il gruppo uscente si spezza, quando il substrato si dissocia (ionizza). Gli elettroni del legame C−OH rimangono sul gruppo uscente e si forma un carbocatione. Nel secondo passaggio, quello veloce, il carbocatione si combina con il Cl- che è il nucleofilo entrante per dare il prodotto finale (cloruro di terz-butile.) Questa reazione avviene con il meccanismo di tipo SN1 in quanto si tratta di un alcol terziario che porta all’intermedio di reazione che è un carbocatione terziaro quindi più stabile. Reazione di tipo SN2: Gli alcoli primari reagiscono quasi sempre secondo il meccanismo SN2 che è un processo costituito da un solo stadio in cui il nucleofilo entrante attacca da retro il legame C−OH. Ad un certo punto, durante la fase di transizione, sia il nucleofilo entrante (Br-) che il nucleofilo uscente (OH-) si trovano parzialmente legati al carbonio su cui avviene la sostituzione. Man mano che OH- si allontana con il suo doppietto elettronico, il Br- fornisce un altro doppietto all’atomo di carbonio. Tale meccanismo è detto SN2 in quanto la reazione è bimolecolare, ossia che due molecole nucleofilo e substrato, partecipano contemporaneamente al passaggio chiave (unico) del meccanismo. Prof Mauro Sabella www.smauro.it [email protected] Laboratorio di chimica organica classe 3 ocb a.s.2010/11 1. OH H3C + H3C Na Br Br ALCOL NORMAL BUTILICO BROMURO DI SODIO BROMURO DI NORMAL BUTILE STATO DI TRANSIZIONE CONFRONTO TRA LA SOSTITUZIONE SN1 E LA SOSTITUZIONE SN2 VARIABILI SN1 SN2 STRUTTURA DEL ALCOL Primario Rara Comune Secondario Osservata a volte Osservata a volte Terziario Comune Rara STEREOCHIMICA Racemizzazione Inversione SOLVENTE La velocità aumenta all’aumentare della polarità del solvente perché gli intermedi sono ionici La velocità è ritardata dai solventi polari protici e accelerata dai solventi polari aprotici. NUCLEOFILO La velocità è indipendente dal la concentrazione del nucleofilo ; il meccanismo è più probabile con i nucleofili neutri. La velocità dipende dalla concentrazione del nucleofilo; il meccanismo è favorito quando il nucleofilo è un anione. Prof Mauro Sabella www.smauro.it [email protected] Laboratorio di chimica organica classe 3 ocb a.s.2010/11 SINTESI DEL CLORURO DI TERZBUTILE DAL ALCOL TERZBUTILICO. (SN1) Reagenti: 20 ml alcol terz-butilico (PM 74, d 0,79) 15,8 g 213 mmoli 50 ml HCl conc. 37% (PM 36, d 1,19) 59,5 g 611 mmoli NaHCO3 soluzione al 5% , Na2SO4 anidro Apparecchiature: imbuto separatore da 250 ml con rubinetto di teflon, pallone da 100 ml, beuta da 100 ml, termometro 0 - 100 ° C, colonna di Vigreux, refrigerante di Liebig con raccordi. Procedimento: 1) In un imbuto separatore da 250 ml con rubinetto di teflon si versano 20 ml di alcol terz-butilico e 50 ml di acido cloridrico concentrato 37%. 2) Si agita piano occasionalmente la soluzione per 20 minuti tenendo l'imbuto separatore sempre diritto, dato il piccolo volume della soluzione, evitando di bagnare il tappo superiore che va aperto periodicamente per sfiatare la pressione interna dovuta alla formazione di isobutene. 3) Si lascia a riposo fino a netta separazione dei due strati, si elimina lo strato acido acquoso inferiore. 4) Si lava il cloruro di terz-butile con 20 ml di una soluzione di bicarbonato di sodio NaHCO3 al 5%. Si agita sfiatando frequentemente la CO2 che si libera. Si lascia decantare e si elimina lo strato acquoso inferiore. Si ripete il lavaggio con 20 ml di acqua e poi si scarica lo strato acquoso inferiore. 5) Si secca con Na2SO4 anidro direttamente nell'imbuto separatore per mezz'ora, si decanta il cloruro di terz-butile in un pallone da 100 ml che va tenuto tappato. 6) Si monta l'apparato per la distillazione frazionata con colonna di Vigreux e si raccoglie, in una beuta raffreddata con ghiaccio, la frazione che passa a 49 - 51° C. Si versa il cloruro di t-butile in una fiala tarata munita di tappo a vite. 7) Si determinano la resa, il punto di ebollizione (51-52° C), lo spettro IR, la purezza tramite GC su colonna non polare. Si analizza con GC anche l'alcol terzbutilico di partenza. Realizzare gli spettri IR dei reagenti e dei prodotti. Prof Mauro Sabella www.smauro.it [email protected] Laboratorio di chimica organica classe 3 ocb a.s.2010/11 SINTESI DEL BROMURO DI NORMAL BUTILE A PARTIRE DALL’ALCOL NORMAL BUTILICO. (SN2) PROCEDIMENTO: Caricare in pallone a due colli da 250 ml 24 g di NaBr, 25 ml di acqua e 17 ml di n- BuOH. In un imbuto gocciolatore inserire 20 ml di H2SO4 conc. e iniziare a gocciolare nel pallone di reazione agitando energicamente la miscela con ancoretta magnetica. In parte l'alcol tenderà a solidificarsi ostacolando l'agitazione, ma la cosa più importante è raffreddare l'ambiente con un bagno di ghiaccio. Terminato il gocciolamento bisogna scaldare con un bagno d'olio per circa un'ora ad una temperatura di 80-100°C. Durante le operazioni sopra descritte si utilizza la configurazione strumentale descritta nella fotocopia allegata. Per intrappolare i bromuri si utilizza una valvola al CaCl2 con un tubo pescante nell'acqua. Terminato il riscaldamento con il bagno d'olio si distilla in corrente di vapore la mix finale e si raccoglie il n-BuBr condensato in testa. La distillazione con Claisen deve essere fatta con termomanto ed ebollitori. Il condensato sarà anche formato da acqua, più leggera del n-BuBr per la minore densità. Dopo raffreddamento si separano le due fasi in un imbuto separatore FASE ORGANICA: Formata da Bromuro di n-butile. Più pesante in quanto il podotto ha una densità superiore a quella dell'acqua. Si separa e si esegue un lavaggio con H2O, NaHCO3, H2O in sequenza, poi si anidri fica con Na2SO4 per assorbire l'eventuale acqua rimasta, e si filtra su cotone. Dopo la filtrazione del prodotto si purifica su Claisen e si pesa per restituire la resa complessiva. FASE ACQUOSA: Più pesante. Costituita da H2O. Può venire eliminata in quanto non è più necessaria per le operazioni successive, controllare prima il pH. CONSIDERAZIONI PRATICHE Questa sintesi segue un meccanismo di tipo SN2 in quanto la molecola che reagisce è una molecola poco ingombrata, avendo il gruppo uscente legato a un carbonio primario. Il prodotto di questa reazione è un alogenuro primario, questa avviene in due passaggi, uno iniziale lento e uno finale veloce. Questa reazione si esegue con NaBr che fornisce il nucleofilo e con H 2SO4 conc. Come catalizzatore. Dalla reazione si formerà HBr volatile, altamente corrosivo e caustico, il quale dovrà essere intrappolato. Inoltre con l'aggiunta dell'acido la reazione svolgerà molto calore, da abbattere con un bagno di ghiaccio. Per purificare il prodotto si farà una distillazione in corrente di vapore con un Claisen stando bene attenti alla temperatura dei vapori. Infatti al termine della distillazione del prodotto (T°C compresa tra 70-90°), un improvviso aumento di temperatura determina l'evaporazione dell'acqua ed eventuali impurezze. Il prodotto e l'acqua costituiscono una miscela azeotropica di minima che formerà due frazioni, smiscelate in due fasi, nel pallone di raccolta. Gli scarti di reazioni quali il pallone di reazione e la trappola di bromuri devono subire un trattamento di neutralizzazione prima di venire scartati. Prof Mauro Sabella www.smauro.it [email protected]
Scaricare