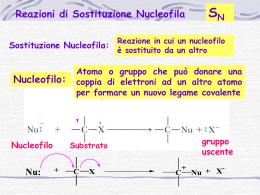
Alogenuri alchilici 1 Reattività di R-X Legame debole .. R–X .. : X, alta affinità elettronica, buon gruppo uscente, X- o Xδ∴ R+ o Rδ+ R elettrofilo attaccabile da un nucleofilo. Un nucleofilo è anche base. 1) Sostituzione Nucleofila R–X + Nu– R–Nu + X– R–X + Nu R–Nu+ X– 2) β-Eliminazione β α H–C–C–X + B– C=C + HB + X– Nucleofilo: specie con disponibilità elettronica: neutro, Nu; carico parzialmente Nuδ– o totalmente Nu– (base) Elettrofilo: specie con carenza elettronica parziale Eδ+ o totale E+ (acido) 2 Due tipi di reazione Gli alogenuri alchilici possono reagire con le basi di Lewis in due modi differenti: sostituzione nucleofila o eliminazione. H C H δ+ C δ- X + :Y – C C Y Sostituzione nucleofila + :X – Due tipi di reazione Gli alogenuri alchilici possono reagire con le basi di Lewis in due modi differenti: sostituzione nucleofila o eliminazione. H C C + :Y – C C + H Y + :X X β-eliminazione – • NUCLEOFILI 5 Sostituzione Nucleofila – Y: δ+ + R δ− X Y – R +: X il nucleofilo è una base di Lewis (donatore di coppie di elettroni), può essere carico negativamente o può essere neutro con una coppia elettronica disponibile Nucleofili .. – : HO .. .. – : HS .. .. – : CH3O .. :N – C: etc. Nucleofili .. – : HO .. .. – : HS .. .. – : CH3O .. :N – C: etc. Non tutti i nucleofili sono anioni. Molti sono neutri. .. .. : NH3 per esempio CH3OH HOH .. .. Nucleofili .. – : HO .. .. – : HS .. .. – : CH3O .. :N – C: etc. Non tutti i nucleofili sono anioni. Molti sono neutri. .. .. : NH3 CH3OH HOH .. .. Tutti i nucleofili, tuttavia, hanno a disposizione una coppia di elettroni non condivisa e sono quindi basi di Lewis. Confronto tra nucleofilicità e basicità La basicità è una misura di quanto prontamente un atomo dona la sua coppia di elettroni al protone (H+) ed è una proprietà termodinamica. La nucleofilicità è invece la misura di quanto prontamente un atomo dona la coppia di elettroni ad atomi diversi da H+. E’ una proprietà cinetica Nucleofilicità Tipo Nucleofilo forte buono I-, HS-, RSBr-, HO-, RO-, CN-, N3NH3, Cl-, F-, RCO2H2O, ROH RCO2H medio debole debolissimo Velocità relativa >105 104 103 1 10-2 • Gli alogenuri alchilici sono caratterizzati dalla presenza di un gruppo –X, attaccato direttamente al carbonio. La sua elettronegatività non solo fa sì che il legame C-X sia polarizzato a favore di quest’ultimo ma comporta anche che tutti i legami C-H, fino al carbonio in β, siano polarizzati a favore dei rispettivi carboni. δ+ δ+ H H C C H H δ+ X δ− δ+ 13 • Questa situazione spiega la reattività degli alogenuri alchilici che può essere riassunta in • 1) sostituzione di X per opera di un nucleofilo (sostituzione nucleofila) • 2) allontanamento di un H+ dal carbonio in β con contemporanea formazione di un doppio legame carbonio-carbonio e uscita dello ione alogenuro (eliminazione) H H Nu C C X H H Nu 14 • • • • Le due diverse reazioni possono avvenire secondo meccanismi differenti che sono determinati da tipo di alogenuri per quanto riguarda sia R (primario, secondario, terziario) sia X forza del nucleofilo e sue proprietà basiche natura del solvente temperatura 15 • Sia per la sostituzione nucleofila che per la βeliminazione esistono due possibili meccanismi: • Sn1 • E1 • Sn2 • E2 16 Il gruppo uscente Gruppo uscente (GU)…vediamolo più da vicino In una sostituzione nucleofila il legame che si rompe è scisso eteroliticamente (cioè i due elettroni del legame si allontano con uno solo dei due atomi, lasciando l’altro carente di elettroni) ed il GU si allontana con la coppia di elettroni formando un anione X:-. Il GU è una specie stabile, neutra o ionica, ma cosa rende una specie un buon GU, cioè tale da contribuire a spostare l’equilibrio verso destra? È chiaro che X:- è più stabile quando è in grado di accettare facilmente la coppia di elettroni. Ma allora un GU è più stabile quanto più è una base debole. 17 Il gruppo uscente Caratteristiche generali • • • • • Per quanto detto, nell’esempio già riportato dell’1-bromobutano, la reazione è reversibile e l’esito dipende da fattori diversi quali il solvente etc. che vedremo in seguito! In generale comunque: lungo la una riga della tavola periodica, la basicità decresce da sinistra verso destra e pertanto la bontà del GU aumenta scendendo lungo una colonna della tavola periodica, la basicità decresce e quindi la bontà del GU aumenta le basi deboli coniugate degli acidi con pKa < 8 sono ragionevolmente buoni GU, mentre le basi forti sono di solito dei cattivi GU l’equilibrio è spostato verso destra quando il GU è una base più debole del nucleofilo 18 Nucleofilo vs base • Un confronto utile Si definisce nucleofilia (con un inglesismo, nucleofilicità) la più o meno spiccata tendenza delle basi di Lewis a condividere una coppia di elettroni con un sito elettrofilo. Ma allora basi e nucleofili sono strutturalmente simili; tuttavia le prime attaccano i protoni, mentre i secondi attaccano altri atomi elettrondeficenti. Generalmente, comunque, una base forte è un nucleofilo forte, inoltre: • 1. per due siti nucleofili con lo stesso atomo nucleofilo, più forte è la base, più forte è il nucleofilo. 2. Procedendo lungo un periodo della tavola periodica, la forza dei nucleofili diminuisce all’aumentare dell’elettronegatività. 19 Nucleofilo vs base • Continuiamo il confronto 3. Gli anioni sono nucleofili più forti dei loro acidi coniugati non carichi. Gli elettroni su un atomo che porta una carica negativa sono meno fortemente trattenuti e quindi più facilmente condivisi rispetto agli elettroni di una molecola non carica. Pertanto, gli anioni alcossido sono nucleofili migliori degli alcoli e gli ioni ammiduro sono nucleofili migliori delle ammine. 4. La forza di molecole non cariche è tanto maggiore quanto più il loro centro nucleofilo si trova in basso in un dato gruppo della tavola periodica. La facilità con cui la nuvola elettronica che circonda un atomo può essere distorta si definisce polarizzabilità dell’atomo. Procedendo dall’alto verso il basso lungo un gruppo della tavola periodica gli atomi sono via via più grandi e in genere più polarizzabili e più nucleofili. 5. Procedendo lungo un gruppo della tavola periodica, la forza dei nucleofili aumenta dall’alto verso il basso. 20 Il solvente Solitamente i reagenti della sostituzione nucleofila sono polari e quindi si usano solventi polari per scioglierli. Esistono solventi polari protici e aprotici. I solventi polari protici sono in grado di dare legami idrogeno; il legame idrogeno fa diminuire la disponibilità degli elettroni non leganti dell’anione e, di conseguenza, il suo carattere nucleofilo. Pertanto, ad esempio, nei solventi ossidrilati lo ione cloruro (anione più piccolo e quindi più solvatato) è un nucleofilo più debole dello ione bromuro! I più comuni sono l’H2O, il metanolo CH3OH, l’etanolo C2H5O, l’acido acetico CH3COOH. 21 Il solvente… e in quelli aprotici? • In chimica, un solvente aprotico è un solvente la cui struttura molecolare non presenta un atomo di idrogeno dissociabile come ione H+. Anche in questi sono presenti interazione dipolo-dipolo, ma in questo caso non c’è formazione di legami idrogeno. Tutti questi solventi hanno un elevato momento dipolare a causa della presenza di gruppi polari, hanno anche alte costanti dielettriche e sono molto efficaci come solventi per reazioni organiche che coinvolgano reagenti o intermedi di reazione ionici. Quando i composti ionici sono disciolti in questi solventi, gli anioni non vengono solvatati così fortemente come avverrebbe in solventi ossidrilati e perciò sono più disponibili per prender parte alle reazioni di sostituzione nucleofila le cui velocità sono, infatti, più elevate di quanto lo siano negli alcoli. 22 sostituzione nucleofila La reazione di sostituzione nucleofila alifatica può procedere con due meccanismi: SN1 (sostituzione nucleofila monomolecolare). SN2 (sostituzione nucleofila bimolecolare) Meccanismi unimolecolari: sostituzione nucleofila unimolecolare (SN1) • Un alogenuro che reagisca con questo meccanismo lo fa in due stadi, il primo dei quali è lento e consiste nella dissociazione dell’alogenuro stesso con formazione del carbocatione. • Nel secondo passaggio, che è veloce, il carbocatione si combinerà con il nucleofilo per dare il prodotto. • Poiché lo stadio lento interessa un solo reagente, il meccanismo è detto unimolecolare, e la velocità globale della reazione dipende solo dalla concentrazione dell’alogenuro v= k [RX] mentre è indifferente sia il tipo di nucleofilo sia la sua concentrazione. 24 25 26 • Inoltre, poiché si passa attraverso la formazione di un carbocatione, questo meccanismo sarà quello preferito dagli alogenuri che formano carbocationi più stabili, come i terziari. 27 28 29 30 Meccanismi bimolecolari: sostituzione nucleofila bimolecolare (SN2) • Quando un alogenuro reagisce con questo meccanismo lo fa in un unico stadio al quale partecipa assieme al nucleofilo. La velocità dipende dunque dalle concentrazioni di entrambi v= k [RX] [Nu-] 31 • Si ha dunque l’ingresso del nucleofilo contemporaneo all’allontanamento del gruppo uscente. 32 • Durante l’attacco i tre sostituenti del carbonio vengono rovesciati nel senso opposto a quello di entrata del nucleofilo: la configurazione del carbonio subisce inversione. 33 • Inoltre, questo meccanismo, in cui il nucleofilo deve farsi strada attraverso i sostituenti presenti sul carbonio, è molto sensibile all’ingombro sterico: gli alogenuri terziari sono quelli che più difficilmente reagiranno mentre quelli metilici sono quelli più favoriti. 34 • La SN2 è favorita è favorita da solventi polari aprotici, come l’acetone, poiché non si legano agli anioni. Il nucleofilo è così libero di arrivare “nudo” al carbonio e di reagire con esso. Un solvente protico, invece, rivestendo il nucleofilo ne renderebbe difficile l’azione. δ− O S δ+ CH3 CH3 δ− δ+ CH3-O-H Nu- 35 Confronto SN1 con SN2 Tendenza alla SN1 metilico primario secondario terziario Tendenza alla SN2 36 Confronto dei meccanismi 37 Eliminazione • Oltre alla sostituzione, gli alogenuri alchilici possono dare la β-eliminazione attraverso due differenti meccanismi: • Monomolecolare (E1) • Bimolecolare (E2) 38 Meccanismi unimolecolari: eliminazione unimolecolare (E1) • Anche quando un alogenuro alchilico procede secondo questo meccanismo, la reazione passa attraverso due stadi. Il primo, che è quello lento e determina la velocità della reazione, è identico al primo della SN1 e consiste nella formazione del carbocatione: 39 • Nel secondo stadio, invece, una base allontana un idrogeno dal carbonio in β, lasciando il doppietto sul carbonio stesso. Immediatamente il doppietto si sposta a formare un doppio legame carbonio-carbonio: 40 • Qualora fossero attaccabili più idrogeni e quindi fossero possibili più alcheni, vale la regola di Zaytzeff, secondo la quale si forma prevalentemente l’alchene più sostituito nella forma trans. + CH3O- → I 18 % 63 % 19 % 41 • Anche in questo meccanismo sono importanti solo le caratteristiche e la concentrazione dell’unico composto che partecipa allo stadio lento della reazione e cioè di RX. • Come già succedeva con la SN1, questo modo di reagire sarà preferito da alogenuri che formano carbocationi più stabili, come terziari e sarà tanto più veloce quanto meglio il gruppo uscente potrà ospitare la carica negativa. 42 Meccanismi bimolecolari: eliminazione bimolecolare (E2) • Quando un nucleofilo ha buone caratteristiche basiche, strappa l’idrogeno in β consentendo così al doppietto che rimane sul carbonio di formare un doppio legame e di allontanare l’alogenuro. 43 • La reazione avviene anche in questo caso in un unico passaggio e la velocità dipende, come nell’SN2, dalle concentrazioni sia del nucleofilo sia dell’alogenuro: v= k [RX] [Nu-] • Vi è dunque, a ulteriore somiglianza con la sostituzione bimolecolare, un momento in cui il nucleofilo e il gruppo uscente sono attaccati contemporaneamente alla molecola ma, poiché l’attacco avviene lontano dal centro di reazione, in questo caso l’ingombro sterico non è un problema. Anzi, gli alogenuri terziari, poiché più ricchi di idrogeni attaccabili, risultano più favoriti in questa reazione. CH3 B: CH3 CH3 C CH3 Br B: B: C C Br Br H CH3 CH3 H H 44 Importanza del gruppo uscente • Il gruppo uscente è tanto migliore se ha una minore densità di carica 45 • E’ invece del tutto ininfluente la forza della base che attacca perché essa non partecipa allo stadio lento. • E1 e SN1 sono meccanismi che interessano contemporaneamente gli stessi composti e la prima (E1) è favorita da temperature più alte, mentre entrambe sono favorite da solventi polari protici che stabilizzano entrambi gli ioni che si ottengono dalla dissociazione dell’alogenuro alchilico. R+ X- 46 • Inoltre la base e il gruppo uscente si pongono da parti opposte dello stesso piano determinando così quale isomero geometrico si ottiene. CH3 CH2CH3 H CH3 CH3 B: C C C C CH2CH3 CH3CH2 CH3 Br CH2CH3 cis-3-esene CH2CH3 H CH3 B: C CH3 CH2CH3 C C C CH3 CH3CH2 CH3 CH2CH3 Br trans-3-esene • Anche in questo caso, come nella E1, si forma sempre l’alchene più sostituito (Zaytzeff). 47 E adesso? 48 • Come facciamo a prevedere secondo quale meccanismo reagiranno un certo alogenuro e un dato nucleofilo? Si decide tenendo conto, in ordine, di : • 1) alogenuro alchilico • 2) nucleofilo/base • 3) solvente • 4) temperatura 49 Nucleofilo scadente Buon nucleofilo debolmente basico H2O, RSH, ROH I-, Br-, CH3COO- Base forte non Base forte impedita impedita stericamente stericamente OH-, CH3O- (CH3)3CO- Alogenuro metilico NON REAGISCE SN2 SN2 SN2 primario non impedito stericamente NON REAGISCE SN2 SN2 E2 primario impedito stericamente NON REAGISCE SN2 E2 E2 secondario SN1 lenta, E1 SN2 E2 E2 SN1, E1 SN1, E1 E2 E2 SN1 SN1 SN1 SN1 terziario benzilico o allilico 50 In linea di massima ricordare che Un metilico può solo dare SN2 Un primario dà solo meccanismi bimolecolari Un terziario dà meccanismi unimolecolari con nucleofili deboli ed E2 con quelli forti I secondari hanno comportamento che dipende da nucleofilo e solvente Un nucleofilo forte, si fa sentire, e spinge verso meccanismi bimolecolari i secondari e Benzilico e allilico danno solo SN1 51 Al lavoro, con un po’ di esercizi Cosa si ottiene da… CH3 CH3CHCH2Br + I- DMSO • Alogenuro primario • Solvente aprotico • Nucleofilo forte/base debole • SN2 CH3 CH3CHCH2I la nucleofilicità degli ioni alogenuro segue l’ordine I-> Br-> Cl-> F-, opposto all’ordine di basicità F-> Cl- > Br - > I -. Sembra che alla base di questo fenomeno vi siano le differenze delle energie di solvatazione degli ioni 52 E questo? Cosa si ottiene da… Br CH3CHCH2CH3 + CH3 S- acetone • Alogenuro secondario • Solvente aprotico • Nucleofilo forte/base debole • SN2 SCH3 CH3CHCH2CH3 Con inversione 53 E ancora… • Cosa si ottiene da Cl + CH3OH CH3OH • Alogenuro secondario • Solvente protico • Nucleofilo debole • SN1/ E1 OCH3 + 54 Stanchi? Cosa si ottiene da… Cl CH3CCH2CH3 + OH- acqua CH3 • Alogenuro terziario • Solvente protico • Nucleofilo forte/base forte • E2 (CH3)2C=CHCH3 prevalente CH2=C(CH2CH3)CH3 55 Vediamo questo Cosa si ottiene da… Cl CH3CHCH2CH3 + CH3OH/H2O T bassa • Alogenuro secondario • Solvente protico • Nucleofilo debole OH • SN1 CH3CHCH2CH3 OCH3 + CH3CHCH2CH3 Con racemizzazione 56 Eh sì, dai, e dopo… Cosa si ottiene da… Cl CH3CHCCH2CH=CH2 + OH- acqua CH3CH3 • Alogenuro terziario • Solvente protico • Nucleofilo forte/base forte • E2 (CH3)2CH (CH3)C=CHCH=CH2 Prevalente. Perché? (CH3)2C=C(CH3)CH2CH=CH2 57 Veloci che è l’ultimo… • Cosa si ottiene da Cl + acetone I- CH3 • Alogenuro secondario • Solvente aprotico • Nucleofilo forte/base debole • SN2 I CH3 58 Ci arrabbiamo se ne arriva ancora uno? Cosa si ottiene da… Br CH3CH2CHCH2CH3 + CH3 O- CH3OH • Alogenuro secondario • Solvente protico • Nucleofilo forte/base forte • E2 CH3CH2CH=CHCH3 59 V. Sostituzione vs Eliminazione C. Unimolecolare: SN1 o E1? OH2 OH Br H2O ∆ base debole Nu debole H OH2 per entrambe, v = k[RBr] ∴ non si controlla il rapporto di SN1 e E1 60 V. Sostituzione vs Eliminazione D. Sommario 1. bimolecolare: SN2 & E2 Favorite da alta concentrazione di buon Nu o forte B buon Nu, debole B: I–, Br–, HS–, RS–, NH3, PH3 favorita SN2 buon Nu, forte B: HO–, RO–, H2N– SN2 & E2 cattivo Nu, forte B: tBuO– (steric. ingombrato) favorita E2 Substrato: 1º RX 2º RX 3º RX principalmente SN2 (tranne che con tBuO–) sia SN2 che E2 (ma principalmente E2) E2 soltanto la ramificazione in β impedisce SN2 61 V. Sostituzione vs Eliminazione D. Sommario 2. unimolecolare: SN1 & E1 Ha luogo in assenza di buon Nu o forte B cattivo Nu, debole B: H2O, ROH, RCO2H Substrato: 1º RX 2º RX 3º RX SN1 e E1 (solo con riarrangiamento) SN1 e E1 (può riarrangiare) non si controlla il rapporto SN1 / E1 62 Sostituzione o Eliminazione? • La forza del nucleofilo determina l’ordine: Nucleofilo forte reagirà SN2 o E2. • Alogenuri primari di solito SN2. • Alogenuri terziari miscela di SN1, E1 o E2. • Alta temperatura favorisce l’eliminazione. • Basi ingombranti favoriscono l’eliminazione. • Buoni nucleofili, ma basi deboli favoriscono la sostituzione. 63 E1 o E2? E1 • Terziario > Secondario • Base debole • Solvente ionizzante • v = k[alogenuro] • Prodotto di Saytzeff • Nessuna geometria richiesta • Prodotti di riarrangiamento • • • • • • • E2 Terziario > Secondario Richiesta base forte Polarità solvente non importante v = k[alogenuro][base] Prodotto di Saytzeff Gruppi uscenti coplanari (anti) Nessun riarrangiamento 64 Riassunto R-X 3° reagiscono con tutti i meccanismi tranne che con SN2 Con basi forti: E2 Con nucleofili o basi deboli: SN1 e E1 R-X 1° reagiscono con SN2 e E2 Con nucleofili forti non ingombrati: SN2 (poco reattivi verso E2) Con nucleofili forti ingombrati: E2 R-X 2° reagiscono con tutti i meccanismi SN1, SN2, E1, E2 Con basi e nucleofili forti: SN2 e E2 Con basi forti ingombrate: E2 Con nucleofili o basi deboli: SN1 e E1 65
Scaricare