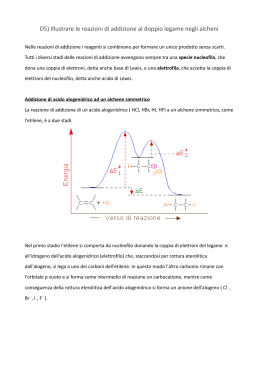
Le reazioni di eliminazione monomolecolare E1 Circa la reattività chimica, un tipo fondamentale di reazione organica è quella di eliminazione, durante la quale un composto saturo diventa insaturo allontanando da sé due atomi o gruppi. Contrariamente alle reazioni di addizione, si ha che un unico reagente organico si divide in due prodotti, in genere con la formazione di una molecola piccola, come H2O o HCl. Si osservi, quindi, come due atomi (o gruppi) legati mediante legami σ a due atomi di carbonio adiacenti ibridati sp3 (uniti quindi tra di loro da un legame semplice) lasciano la molecola e vengono sostituiti dalla formazione di un secondo legame, di tipo π, tra i due atomi di carbonio, che assumono pertanto una ibridazione sp2. Tale tipo di reazione è favorita quando gli alogenuri alchilici, elettrofili, reagiscono con nucleofili/basi; questi ultimi possono, difatti, promuovere l’eliminazione di HX per fornire un alchene. Usando, così, un alogenuro alchilico come substrato, il decorso della reazione porta all’allontanamento di un atomo di alogeno e di uno di idrogeno della molecola, pertanto la trasformazione viene definita deidroalogenazione. C’è da specificate, tuttavia, che differenti possono essere i meccanismi secondo i quali l’eliminazione può verificarsi, a causa dei diversi tempi di rottura dei legami C – H e C – X. A contraddistinguere l’eliminazione monomolecolare E1 è che essa non avviene in un unico passaggio, senza la formazione di intermedi, come accade, invece, nell’eliminazione E2. Il suo meccanismo prevede più di uno stadio, precisamente due, e lo stadio cineticamente determinante coinvolge il solo alogenuro alchilico. In un primo momento si osserva quella che è l’eterolisi del legame C – X : tale dissociazione spontanea dell’alogenuro alchilico terziario porta ad un carbocatione intermedio in uno stadio lento, che determina la velocità della reazione. Successivamente il carbocatione subisce l’estrazione di H+ da parte della base, che rimuove il protone dal carbonio adiacente al carbocatione; la perdita dell’ H+, nello stadio veloce, fornisce come prodotto l’alchene neutro, difatti la coppia di elettroni del legame C – H viene utilizzata per formare il legame π dell’alchene. Un esempio del meccanismo della reazione E1 sopra descritto è mostrato nella figura sottostante relativamente alla eliminazione di HBr dal 2-bromo-2-metilpropano. CARBOCATIONE E Ben evidente è come nel primo stadio, quello lento e cineticamente determinante, avvenga l’eterolisi del legame C – Br , la quale porta alla dissociazione spontanea del bromuro alchilico terziario, causando la formazione di un carbocatione intermedio. È quest’ultimo a subire nello stadio veloce, il secondo, l’estrazione di un H+ adiacente, fornendo come prodotto l’alchene neutro, il cui legame π si è potuto formare grazie alla coppia di elettroni del legame C – H. Il meccanismo finora trattato è monomolecolare, cioè segue una cinetica di primo ordine: ciò sta a significare che la velocità della reazione è direttamente proporzionale alla concentrazione di un solo reagente e che, quindi, una sola specie (il substrato) partecipa allo stadio di cui si misura la velocità; per tale motivo esiste un’analogia e una forte competizione tra E1 e SN1. Le eliminazioni E1 iniziano con la medesima dissociazione monomolecolare, per dare un carbocatione, presente anche nelle reazioni S N1, ma a questa dissociazione segue la perdita di H+ dal carbonio adiacente, anziché la sostituzione. Infatti le reazioni E1 e SN1 normalmente decorrono in competizione tutte le volte che un alogenuro alchilico è trattato in un solvente protico con un nucleofilo poso basico. Pertanto i migliori substrati delle E1 sono anche i migliori substrati delle SN1 e di regola si ottengono miscele di prodotti di sostituzione ed eliminazione. Più nello specifico, nell’analisi delle reazioni di eliminazione E1 è importante considerare quattro fattori. 1. Concentrazione della base: nella reazione E1 non è rilevante poiché si ha una cinetica di primo ordine, di conseguenza la velocità della reazione è indipendente dalla concentrazione del nucleofilo. 2. La struttura del substrato: gli alogenuri alchilici più sostituiti sono i più reattivi; essi creano carbocationi più stabili, il che significa che l’energia di attivazione delle reazione è più bassa, pertanto la reazione è più veloce. Si può affermare quindi che la velocità di una reazione E1 aumenta all’aumentare dei gruppi R sul carbonio che porta il gruppo uscente. 3. La reattività della base: anche tale fattore non riveste alcuna importanza, in quanto la base interviene nello stadio veloce della reazione, ed è normalmente rappresentata dal solvente. 4. Il solvente della reazione: solventi molto polari e protici favoriscono la ionizzazione del substrato, giocando a favore del meccanismo E1. C’è da specificare, inoltre, circa i requisiti sterici, che per le eliminazioni E1, avvenendo in due stadi, non si può parlare di approccio sin o anti della base rispetto al gruppo uscente, poiché quando la base interviene, l’alogeno si è già dissociato. Infine, anche per tali reazioni risulta essere valida la regola di Zaitsev, secondo la quale reazioni di eliminazione, indotte dalle basi, generalmente danno come prodotto l’alchene più sostituito, ossia quello con il maggior numero di sostituenti alchilici sul doppio legame. La reazione E1cB Il meccanismo E1Cb (cB sta per base coniugata), predominante nei processi biologici, decorre attraverso la formazione di un carbanione intermedio, differendo dal meccanismo E1, il quale invece coinvolge un carbocatione come intermedio. Anche in questo caso il processo avviene in due stadi, tuttavia, stavolta, l’estrazione del protone da parte della base avviene prima: si assiste alla rottura del legame C – H nel primo stadio; si determina, così, la formazione di un carbanione intermedio, il quale solo nello stadio successivo perde X per dare l’alchene. La reazione è particolarmente comune nei substrati che hanno un cattivo gruppo uscente, come – OH, distante due atomi di carbonio da un gruppo carbonilico OH – C – CH – C = O.
Scaricare