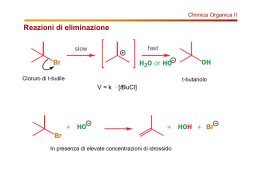
γ eliminazione molto molto rara. carbene α eliminazione e’ osservabile, per esempio cloroformio con la soda da alfa-eliminazione. alfa Β eliminazione la piu’ comune. E2: Attacco di un protone in posizione β, e simultanea rottura del legame in cis C-X. Avviene senza intermedio. E1, parallelo di Sn1: si stacca XX e si forma il carbocatione, una base stacca un H e si forma il doppio legame. E1cb (Coniugate Base): prima attacca la base che deprotona il reagente, reagente poi dal carbanione rimasto (base coniugata con del reagente) si stacca X-. La E1cb passa attraverso un intermedio. E’ come una E1 con gli step invertiti. Questi sono gli estremi, ovviamente esiste un continuo di possibilita’ intermedie attraverso le quali avvengono le reazioni di eliminazione. Diagramma delle varie eliminazioni. Ai due estremi la E1cb e la E1, la E2 puo’ essere sincrona o avere carattere piu’ simile alla E1 o alla E1cb C-X Cosa influenza le reazione di leiminazione 1) naruta del gruppo uscnete 2) natura della base 3) effetti sterici e elettronici 4) effetti del solvente Sull’asse X del grafico abbiamo l’energia. Fare il percorso diretto e’ la E2, passare dai due minimi porta a E1cb o E1. Diagramma di More o’ Ferral erral E2 La scelta dei percorsi non puri e’ influenzata dalla presenza di fattori che stabilizzano il carattere carbocationico della reazione. “Le donne stabilizzano la corsa di un gruppo di uomini” (cit.) Cosa stabilizza la E1 (o E1-like): - sostituenti elettrondonatori che stabilizzano la carica positiva buoni gruppi uscente solventi polari (perche’ l’intermedio e’ carico, favorisce anche la E1cb) la base non ha nessun ruolo la reazione successiva e’ influenzata dal carbocatione, la E1 si ottiene con una base forte, la sn1 con un nucloefilo forte. Caratteristiche degli E2 e E1cb: - la base e’ presente nello step lento x tutti e due - hanno cinetica del secondo ordine (la E1 ha cinetica del primo ordine) - la base ha importanza nell’energia dello stato di transizione, cosi’ come il gruppo gruppo uscente e il solvente. - Basi forti favoriscono la E1cb contro la E2 - Gruppi uscenti deboli favoriscono la E1cb - Solventi polari con buoni gruppi uscenti favoriscono la E1, con cattivi gruppi uscenti la E1cb - La E1cb e’ favorita da sostituenti EA che favoriscono la formazione del carbanione: il gruppo uscente in β a C=O, NO2, SOnR, CN ecc.. Esempi: Regiochimica Nel meccanismo E1 la formazione dell’alchene piu’ sostituito e’ favorita. I motivi sono la stabilita’ dell’alchene piu’ sostituito, tuttavia il secondo passaggio e’ quello veloce, quindi lo stato di transizione dovrebbe essere piu’ simile ai reagenti che ai prodotti. L’iperconiugazione e’ un effetto mesomero sugli elettroni σ. Tuttavia l’idrogeno a destra intereagisce col carbocatione per effetto di iperconiugazione. Nel meccanismo E1cb e’ favorito l’alchene meno sostituito. Nell’e1cb la cinetica e’ governata dallo stadio lento che e’ quello piu’ determinante. Conta l’effetto sterico che rende piu’ difficile l’attacco e il fatto che i sostituenti alchilici destabilizzano la carica negativa, quindi favorisce l’attacco al meno sostituito Caso E2 Il puro meccanismo E2 porta all’alchene all’ piu’ sostituito altrimenti la sostituito, reazione segue le regole della E1 o della E1cb a seconda della somiglianza della E2 con una delle due. Due fantastiche regole: Regola di Saytzeff: si forma l’alchene piu’ sostituito (lui osservava le E1 o le E2) Regola di Hoffmnn: si forma l’alchene meno sostituito (lui osservava le E1cb) Esempi: Diastereoisomeri: non sono immagine speculare uno dell’altro. Effetti Sterici: Altri esempi Stereochimica delle reazioni E2: Due diversi prodotti nella e2 a seconda che sia una syn o una anti eliminazione Esempio di meccanism anti Anti e’ favorita da motivi sterici e anche dall’effetto Stereoelettronico gli Stereoelettronico: elettroni entranti ed uscenti tendono a stare lontani per diminuire questo effetto. Nella syn ci sn molti elettroni vicini e aumenta la repulsione. Alogenuri equantoriali non danno nè una syn nè una anti eliminazione. Un alogenuro equatoriale la reazione e’ molto piu’ lenta. Esempi in cui e’ favorita l’eliminazione syn: - Sistemi in cui la anti non puo’ avvenire, e’ presente un ciclo rigido per p esempio Effetti della coppia ionica Effetti sterici
Scaricare