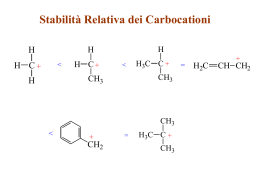
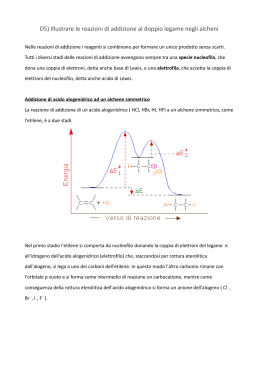
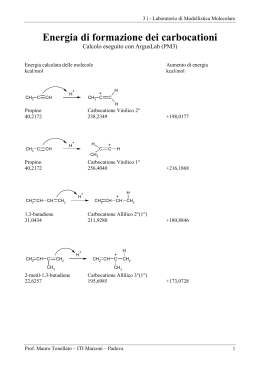
ALCHENI • Il gruppo funzionale alchenico consiste in due atomi di C ibridizzati sp2 legati tramite un legame p e s. •I 2 C del C=C e i 4 atomi legati direttamente al C=C sono tutti disposti sullo stesso piano. ALCHENI Stabilità: ci sono 3 fattori che influenzano la stabilità degli alcheni: 1. Grado di sostituzione: più sono alchilati gli alcheni maggiore è la loro stabilità, quindi tetra > tri > di > mono-sostituiti. 2. Stereochimica: trans > cis , a causa della ridotta interazione sterica dei gruppi R disposti ai lati opposti del doppio legame. 3. Gli alcheni coniugati sono più stabili degli alcheni isolati. Reattività • un legame p è una regione ad alta densità (rosso) di elettroni, quindi gli alcheni si comportano da nucleofili • gli alcheni danno reazioni di addizione che convertono il legame p in due nuovi legami s. R1 R3 C R2 C R4 R1 A B R3 R2 C C R 4 A B La molecola A-B è addizionata per intero al composto insaturo Queste reazioni si chiamano reazioni di addizione ADDIZIONE ELETTROFILA (con acidi alogenidrici) Fasi principali del meccanismo di reazione H xy H s H H H+ + H xy s H H H H H - Cl Formazione del prodotto xy H H s H p Formazione di un carbocatione e attacco della particella nucleofila H Generazione della particella elettrofila e attacco al doppietto di e- p Cl ADDIZIONE ELETTROFILA AL DOPPIO LEGAME Addizione elettrofila ad un alchene asimmetrico Regola di Markovnikov (empirica): “quando un alchene asimmetrico reagisce con un acido alogenidrico per formare un alogenuro alchilico, l’idrogeno si addiziona al carbonio dell’alchene che è legato al maggior numero di atomi di idrogeno e l’alogeno al carbonio che è legato al minor numero di atomi di idrogeno” STABILITA’ I gruppi alchilici sono elettron donatori e quindi per effetto induttivo tendono a stabilizzare la carica positiva del carbocatione. Orbitale p (non ibrido) vuoto Poiché i carbocationi hanno un ottetto incompleto si comportano da eccellenti elettrofili e reagiscono rapidamente con nucleofili. Alternativamente possono perdere un H+ e generare un legame p. ADDIZIONE ELETTROFILA (con alogeno) IONE BROMONIO MECCANISMO ADDIZIONE ELETTROFILA (con alogeno) IDRATAZIONE AL DOPPIO LEGAME (catalisi acida) N.B. questa razione è resa possibile in presenza di un acido forte, perché la base coniugata che si forma essendo molto debole sarà anche un nucleofilo scadente (ad es. SO4--). Questo permette all’H2O di competere con successo nell’attacco nucleofilo. IDRATAZIONE AL DOPPIO LEGAME (catalisi acida) H H H C H + + H C H carbocatione secondario CH3 Si ottiene 2-cloropropano in quanto nella prima tappa si forma preferenzialmente il carbocatione secondario. H H H C C CH3 + Cl+ H + H H C C CH3 H H H C C CH3 + H carbocatione primario H H H C C CH3 H Cl IDROGENAZIONE AL DOPPIO LEGAME (catalisi eterogenea) H C C CH3 H H H+ C C H CH3 C C + H + H CH3 C CH3 H O H C OH2 + enolo protonato H H C CH3 H OH2 H C H H + CH3 C C H O H CH3 C + H+ C O H enolo H3C CH3 C O propanone H H C C Br CH3 H C Br C Br Br C C Br Br CH3 Br Br H Br Br CH3 Br C C CH3 Br Meccanismo di polimerizzazione “ionica” degli alcheni Nu- (nucleofilo scadente) H+ H H H C H H H C C+ H H H C+ H H H H H H H H C H H C C H H C C C C H C H H + H H H H H H H C H C C H C H H H + H H C C H H Polietilene H C H H C R Polietilene (PE) Polipropilene (PP) Polivinil chloruro (PVC) Polistirene (PS) Molecole con più di un doppio legame •I sistemi con più di un C=C sono definiti “polieni”. •I più semplici polieni sono quelli in cui ci sono 2 doppi legami, i “dieni". •La posizione relativa dei doppi legami determinano le caratteristiche di reattività del sistema. •Sono possibili tre differenti configurazioni. Cumuleni Dieni isolati Dieni coniugati C C C Tutti e 4 i carboni sono ibridati sp2 C Tutti gli atomi nel diene coniugato giacciono sullo stesso piano Coniugazione Il termine coniugazione deriva dal latino“mettere insieme". In chimica organica è un termine usato per descrivere sistemi in cui elettroni p “legati insiemie. •Un sistema a elettroni p è detto isolato quando esiste solo tra una coppia di atomi adiacenti (es. C=C) •Un sistema ad elettroni p è detto coniugato quando si estende su una serie più lunga di atomi (es. C=C-C=C or C=C-C=O etc.). •Un sistema ad elettroni p coniugato si traduce in una estensione della reattività chimica. •Un sistema coniugato richiede che ci sia un allineamento di orbitali p, tali da produrre una sovrapposizione di legami p sull’intera molecola. •Se una posizione nella catena non è dotata di legami p, o la geometria della molecola previene il corretto allineamento, la coniugazione è interrotta e quindi persa in quel punto. ADDIZIONE ELETTROFILA AI DIENI CONIUGATI 1 H 1 H2C C 2 H Br HC 3 C CH2 4 CH2 C 2 C H H addizione 1,2 H H -- Br 1 H Br C CH2 H2C C H H 4 addizione 1,4 Acido bromidrico 1,3 butadiene Distribuzione del potenziale elettrostatico HBr Br - H+ Attacco elettrofilo + carbocatione secondario + carbocatione allilico + Br- + Equilibrio di risonanza: spostamento di un doppietto di elettroni dalla posizione 1-2 a quella 2-3, spostamento della carica positiva dal C3 al C1. Differenti prodotti di reazione a seconda di quale sia il carbocatione “attaccato” dal nucleofilo. Reazioni a controllo cinetico e termodinamico Reazione cineticamente favorita G Reazione termodinamicamente favorita Poliisoprene I TERPENI SONO POLIMERI NATURALI DELL’ISOPRENE
Scaricare